预约演示
我国药品上市许可持有人制度相关法规政策
医药出海引进/卖出
新《药品管理法》(2019年12月1日实施)确定MAH制度正式全国推广实施,使得药品研发个人、研发机构、营销企业、科技公司、商贸公司等不具备相应生产资质的主体,也可以成为MAH,这大大刺激了新药研发创新的积极性,为药品行业的发展提供了助推剂,鼓励MAH研发创新和产业化,开展MAH制度,与现行管理制度最主要的区别在于,允许研发机构及科研人员持有药品批准文号,成为药品上市许可持有人,并对该药品的安全性、有效性和质量可控性负全面责任。笔者梳理了NMPA网站上关于我国MAH制度的相关政策法规,分享给大家,如有遗漏或不足,欢迎大家留言讨论。一、MAH制度的概述
MAH,英文全称为Marketing Authorization Holder(简称“MAH”),中文全称药品上市许可持有人制度,是指取得药品注册证书的企业或者药品研制机构等主体对药品质量承担全生命周期主要责任的制度,MAH制度最突出优势是将上市许可(药品批准文号持有人)与生产企业相分离,允许药品上市许可持有人自行生产药品或委托药品生产企业生产的制度。
二、我国MAH制度相关法规政策
我国MAH制度自从2015年开始在中国序幕,药监机构和MAH等相关方法边探索、边实践,摸着石头过河,围绕MAH制度配套的法规指南不断颁布和落地实施,走出一条适合我国国情、具有中国特色的MAH之路,笔者梳理了我国MAH制度的主要相关政策。
Preview
来源: 行舟Drug
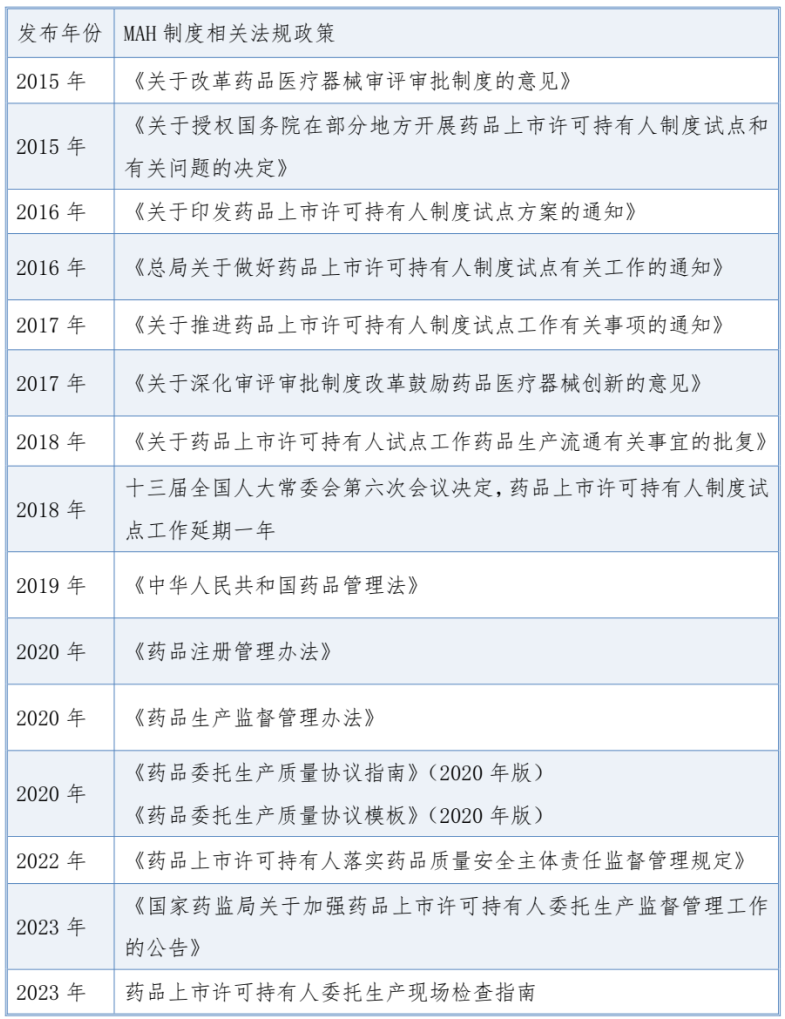
1. 首次提出“开展药品上市许可持有人制度”
Preview
来源: 行舟Drug
2015年8月18日,国务院颁布《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号),首次提出“开展药品上市许可持有人制度”。
Preview
来源: 行舟Drug
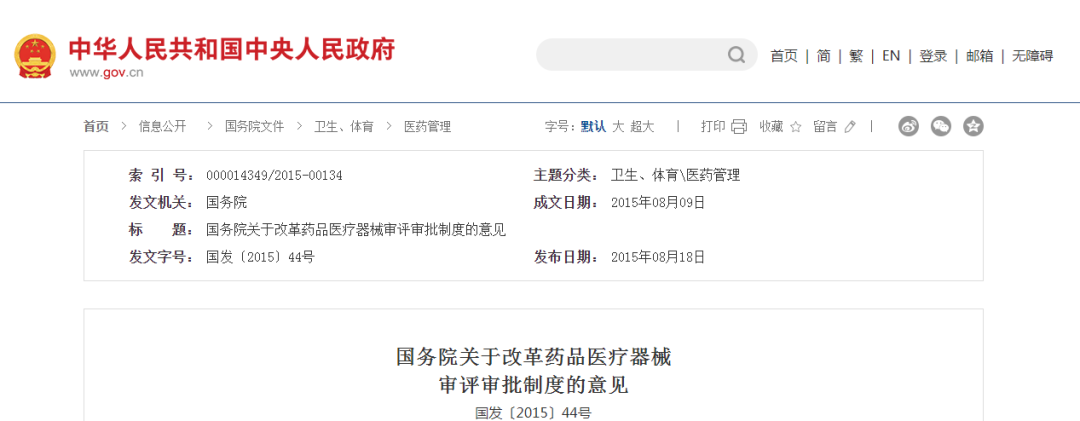
2. 药品MAH制度改革试点的大幕在我国正式拉开

Preview
来源: 行舟Drug
2015年11月4日,我国首次提出授权国务院开展药品上市许可持有人制度试点,国务院和试点地区随后也相应出台了试点方案-《关于授权国务院在部分地方开展药品上市许可持有人制度试点和有关问题的决定》,自2015年11月5日起施行,本决定授权的试点期限为三年,自本决定施行之日起算。
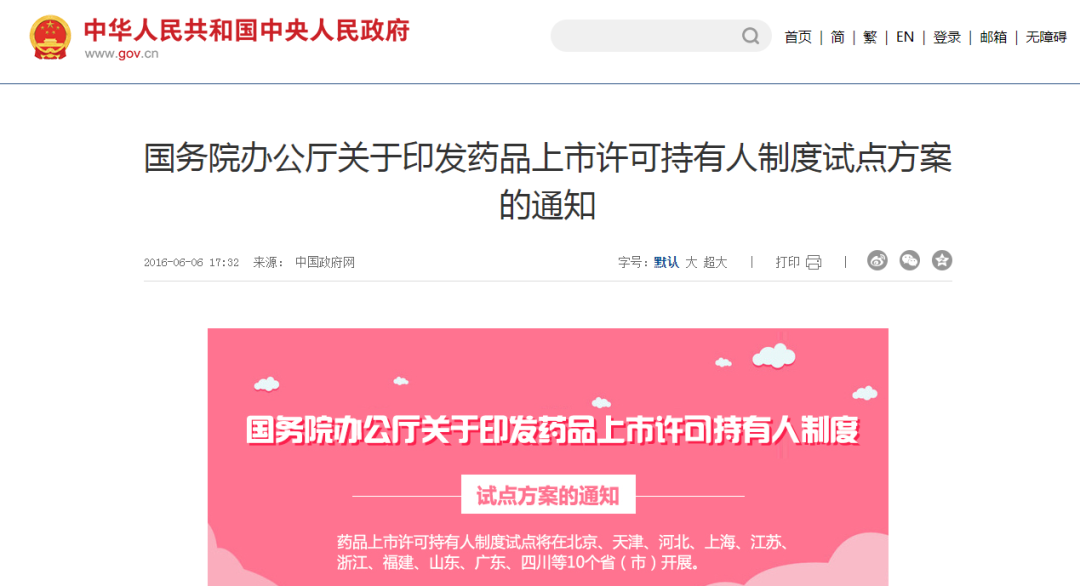
3. 我国首次在十个省市开展MAH制度试点
Preview
来源: 行舟Drug
2016年6月6日,国务院办公厅发布了《关于印发药品上市许可持有人制度试点方案的通知》(国办发〔2016〕41号),明确了试点内容、试点品种范围、持有人条件、持有人责任义务等。试点省市为:北京、天津、河北、上海、江苏、浙江、福建、山东、广东、四川。
Preview
来源: 行舟Drug
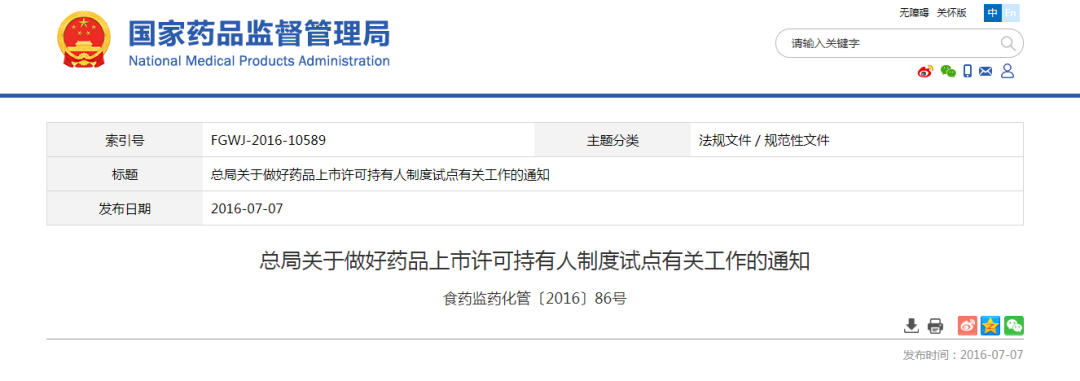
4. 国家药监局鼓励符合条件的申请人申报参加试点2016年7月7日,国家局《总局关于做好药品上市许可持有人制度试点有关工作的通知》(食药监药化管〔2016〕86号),鼓励符合条件的申请人申报参加试点。
Preview
来源: 行舟Drug
5. 进一步推进MAH制度试点工作

Preview
来源: 行舟Drug
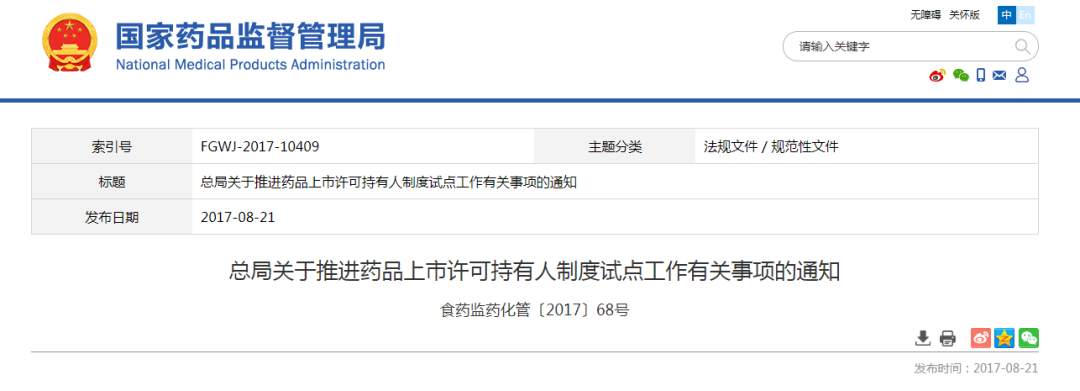
2017年08月21日,原食品药品监管总局发布《关于推进药品上市许可持有人制度试点工作有关事项的通知》食药监药化管〔2017〕68号,加快推进持有人制度试点工作。
6. 推动上市许可持有人制度全面实施
Preview
来源: 行舟Drug
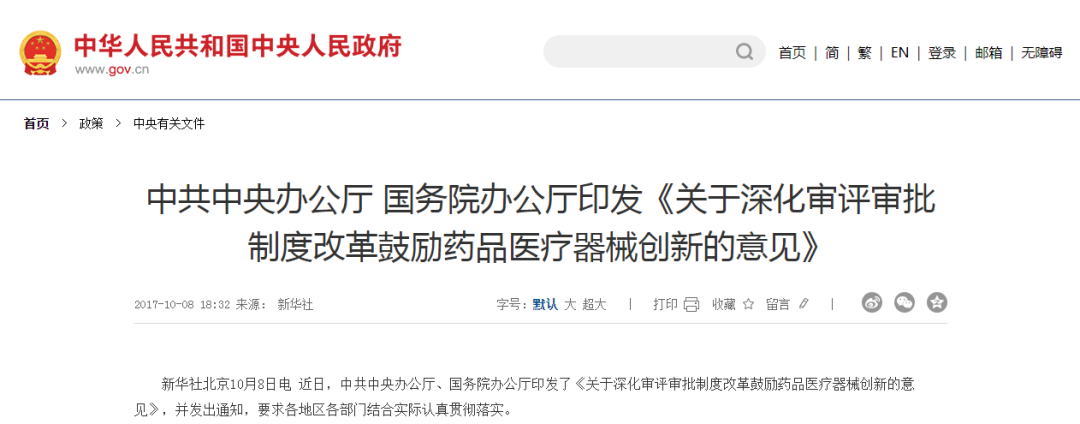
2017年10月8日电 近日,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,要求各地区各部门结合实际认真贯彻落实。
7. 关于试点工作药品生产流通有关事宜的批复
Preview
来源: 行舟Drug
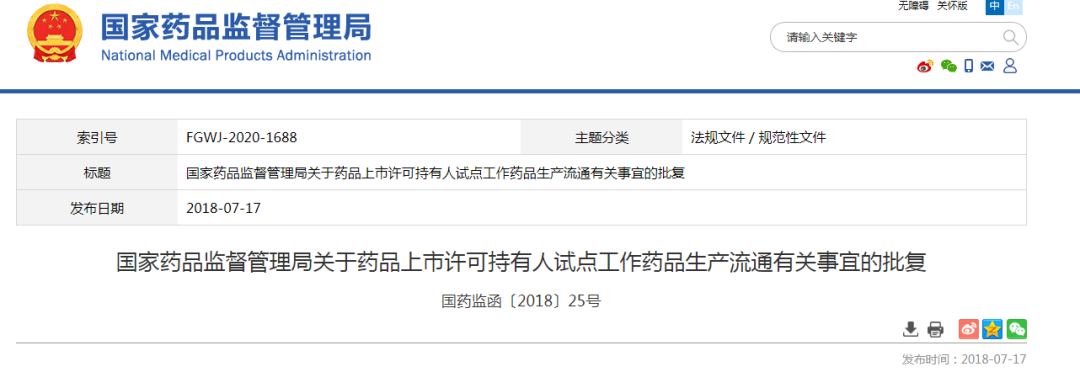
2018年7月,国家药品监督管理局发布《关于药品上市许可持有人试点工作药品生产流通有关事宜的批复》(国药监函〔2018〕25号)。
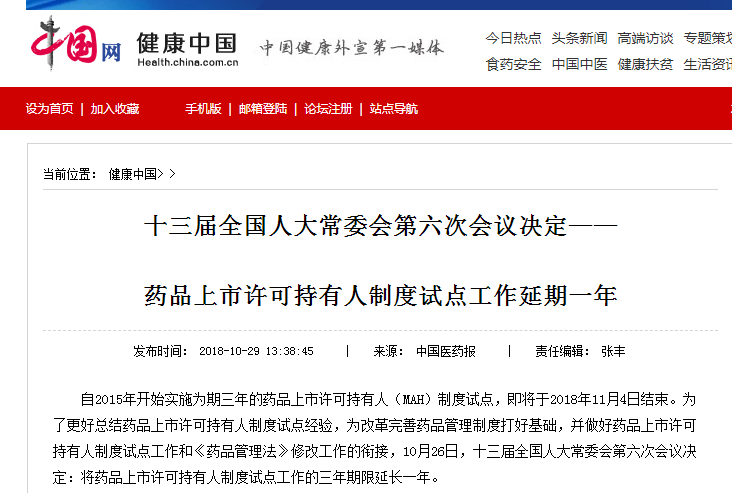
8. MAH制度试点工作延期一年
Preview
来源: 行舟Drug
2018年10月,十三届全国人大常委会第六次会议决定,药品上市许可持有人制度试点工作延期一年。
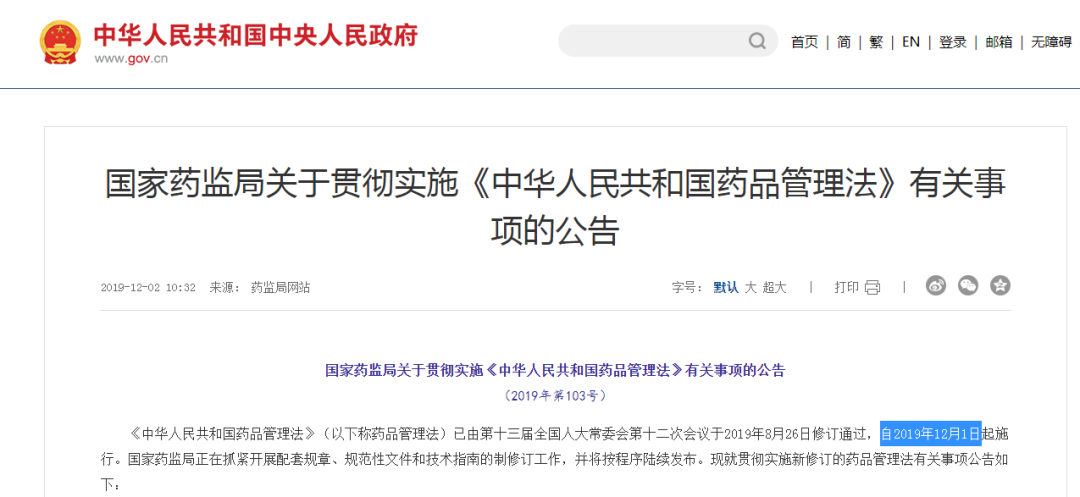
9. 正式全国推广实施MAH制度
Preview
来源: 行舟Drug
2019年12月1日,开始施行的修订版《药品管理法》,设置“药品上市许可持有人”专章确定了MAH制度,标志着MAH制度在我国的全面实施,自2019年12月1日起。
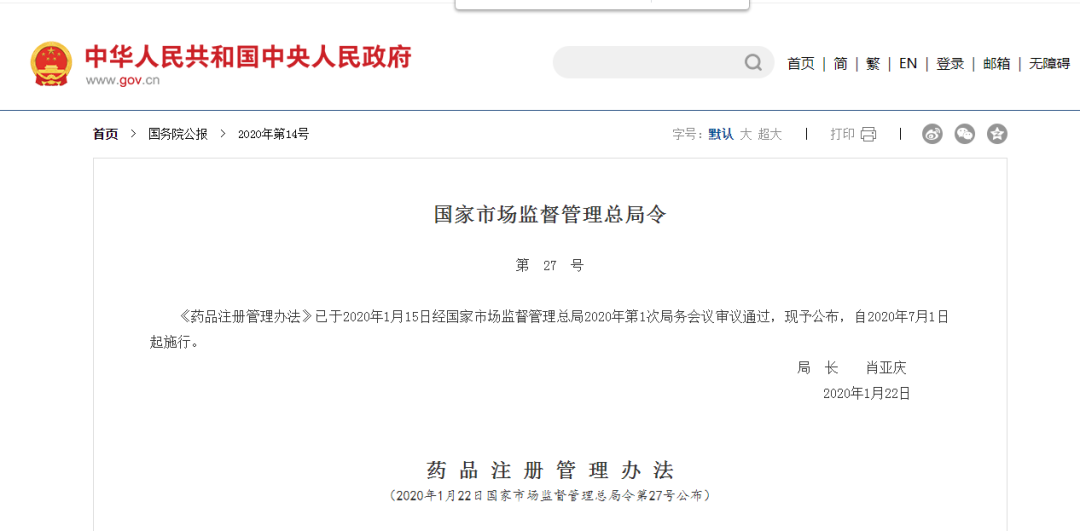
10.明确药品申请人取得药品注册证书后,为药品上市许可持有人
Preview
来源: 行舟Drug
《药品注册管理办法》已于2020年1月15日经国家市场监督管理总局2020年第1次局务会议审议通过,自2020年7月1日起施行。明确药品申请人取得药品注册证书后,为药品上市许可持有人(以下简称持有人)。
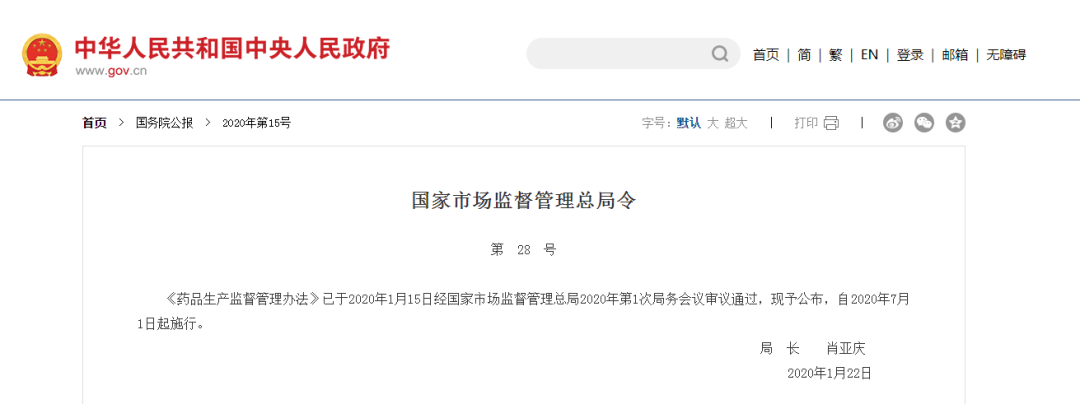
11. 明确药品上市许可持有人应当建立药品质量保证体系
Preview
来源: 行舟Drug
2020年7月1日,开始施行的修订版《药品生产监督管理办法》规定:药品上市许可持有人应当建立药品质量保证体系。
12. 《药品委托生产质量协议模板》发布

Preview
来源: 行舟Drug
2020年10月,国家药监局关于发布药品委托生产质量协议指南(2020年版)的公告(2020年第107号),发布了《药品委托生产质量协议指南》(2020年版)、《药品委托生产质量协议模板》(2020年版)。
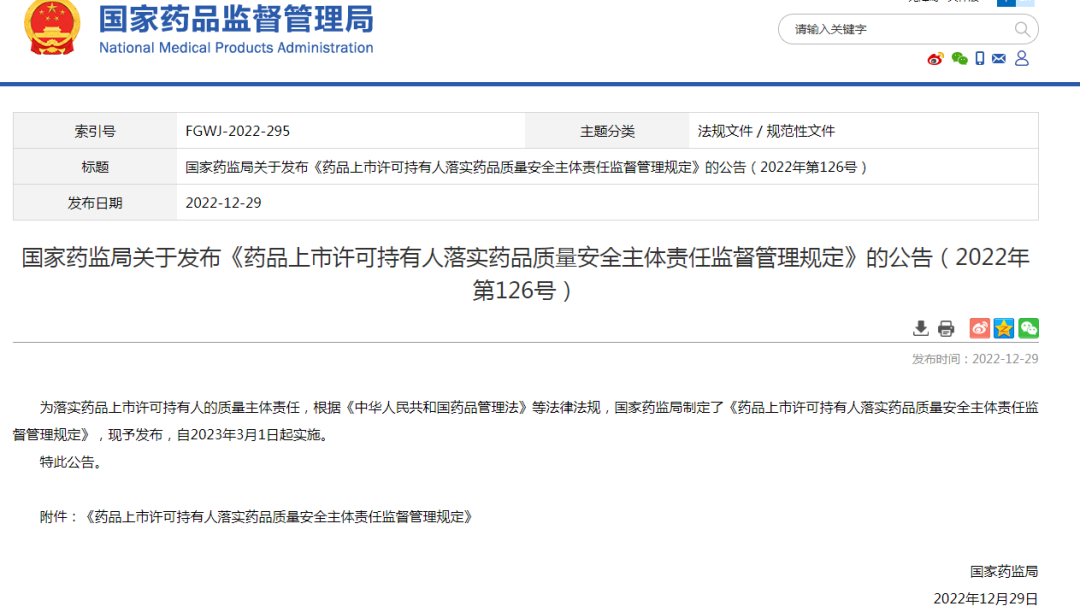
13. 落实持有人的质量主体责任
Preview
来源: 行舟Drug
2022年12月29日,为落实药品上市许可持有人的质量主体责任,根据《中华人民共和国药品管理法》等法律法规,国家药监局制定了《药品上市许可持有人落实药品质量安全主体责任监督管理规定》,现予发布,自2023年3月1日起实施。
14. 加强药品上市许可持有人委托生产监督管理

Preview
来源: 行舟Drug
2023年10月23日,为进一步落实药品上市许可持有人(以下简称MAH)委托生产药品质量安全主体责任,保障药品全生命周期质量安全,国家药监局官网正式发布了《国家药监局关于加强药品上市许可持有人委托生产监督管理工作的公告》(2023年第132号),2023年10月23日起执行,这份新规发布当天引起行业的热议,也有被业界称为“7.22惨案”(2.0版),也看出了国家局加强药品生产B证MAH的委托生产监管收紧的信号,对于重点品种如无菌制剂、生物制品、中药注射剂、多组分生化药等,不仅提出了对关键岗位的人员资质、质量管理体系建设和运行情况等重点环节和内容的明确要求,还明确了持有人履行质量安全主体责任应加强的重点工作。
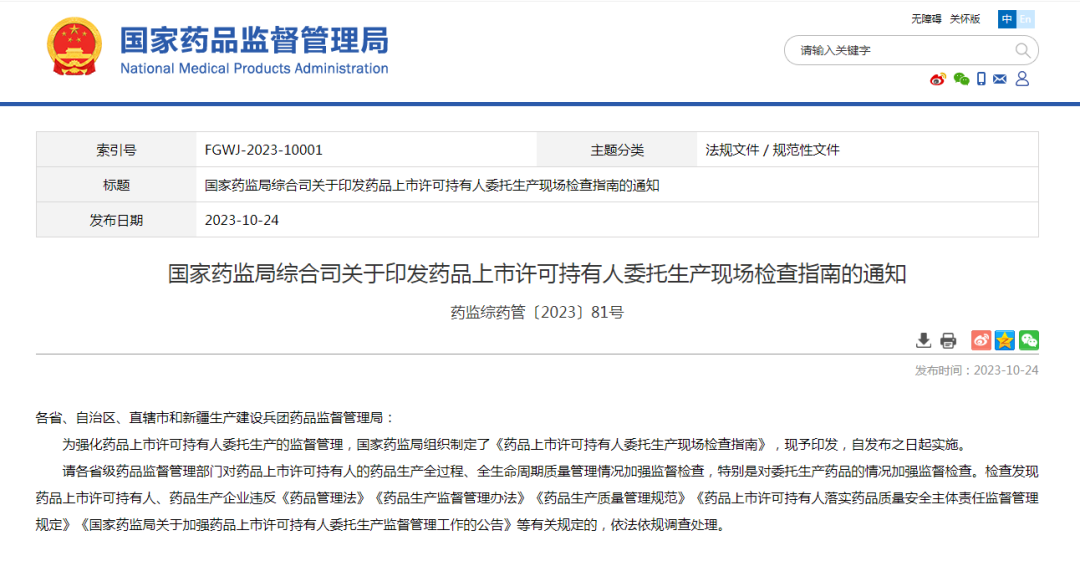
15. 我国首部专门针对MAH的检查指南
Preview
来源: 行舟Drug
2023年10月24日,国家药监局网站发布《国家药监局综合司关于印发药品上市许可持有人委托生产现场检查指南的通知》(药监综药管〔2023〕81号),自发布之日起执行,该检查指南共涉及4大项67小项的检查。
参考文献[1] 国务院、国家药监局、各地方药监局官网等
内容来源于网络,如有侵权,请联系删除。
机构
-适应症
-靶点
-药物
-生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。


