预约演示
十六省药品联盟采购公告:启动第三、五批国家集采协议期满药品集中带量采购
带量采购一致性评价
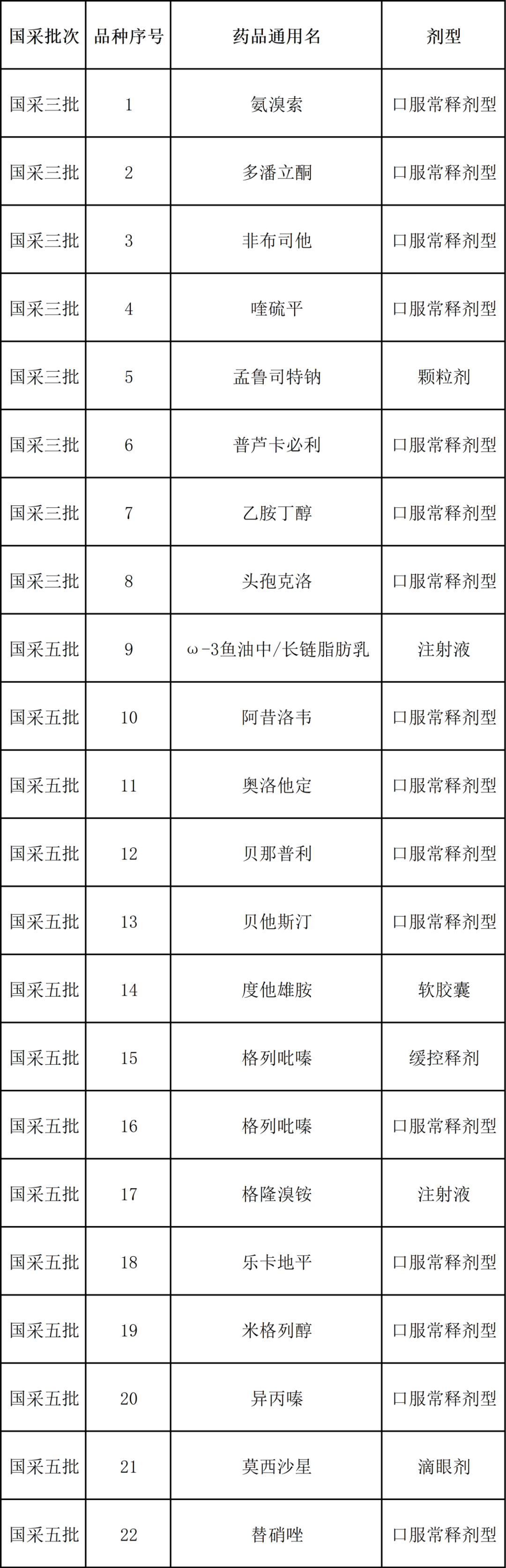
近日,湖南省医保局发布公告称,河南、河北、山西、内蒙古、辽宁、吉林、黑龙江、湖北、湖南、广西、海南、贵州、青海、宁夏、新疆和新疆生产建设兵团等16省(自治区、直辖市、兵团)组成省际联盟,拟对第三、五批国家组织药品集中带量采购协议期满药品开展集中带量采购。本次共有22个协议期满接续采购品种被纳入采购清单,企业申报品种须属于采购品种目录范围并获得国内有效注册批件的上市药品,且满足以下要求之一:1.原研药及国家药品监督管理局发布的仿制药质量和疗效一致性评价参比制剂。2.通过国家药品监督管理局仿制药质量和疗效一致性评价的仿制药品。3.根据《国家食品药品监督管理总局关于发布化学药品注册分类改革工作方案的公告》(2016年第51号)或《国家药监局关于发布化学药品注册分类及申报资料要求的通告》(2020年第44号),按化学药品注册分类批准,并证明质量和疗效与参比制剂一致的仿制药品。4.纳入《中国上市药品目录集》的药品。注射用混悬液
各相关生产企业:为贯彻落实《国家医疗保障局办公室关于做好国家组织药品集中带量采购协议期满后接续工作的通知》(医保办发〔2021〕44号)文件精神,减轻群众医药负担,河南、河北、山西、内蒙古、辽宁、吉林、黑龙江、湖北、湖南、广西、海南、贵州、青海、宁夏、新疆和新疆生产建设兵团等16省(自治区、直辖市、兵团)组成省际联盟,拟对第三、五批国家组织药品集中带量采购协议期满药品开展集中带量采购。十六省(区、市、兵团)委派代表组成联合采购办公室,由河南省医疗保障局承担联盟采购日常工作,相关公告由河南省医疗保障局代章印发。现就相关事宜公告如下,并对采购文件公开征求意见:一、采购品种结合国采执行实际情况,本次接续采购统筹考虑国采时竞争是否充分、降价是否到位等因素,区分采购单一、采购单二分别进行集中带量采购(具体分组另行公布)。期满接续采购品种
Preview
来源: 药通社
注:1.口服常释剂型包含:普通片剂(片剂、肠溶片、包衣片、薄膜衣片、糖衣片、浸膏片、分散片、划痕片)、硬胶囊、软胶囊(胶丸)、肠溶胶囊。2.缓释控释剂型包含:缓释片、缓释包衣片、控释片、缓释胶囊、控释胶囊。3.注射剂包含:注射剂、注射液、注射用溶液剂、静脉滴注用注射液、注射用混悬液、注射用无菌粉末、静脉注射针剂、注射用乳剂、乳状注射液、粉针剂、针剂、无菌粉针、冻干粉针、注射用浓溶液。4.滴眼剂包含:滴眼剂、滴眼液。5.采购单一原国采最低中选价根据原国采时企业报价参照有关差比价规则折算至最小比价单位。6.有关品种参加联盟省份以公布报量数据为准。二、申报要求(一)申报企业资格提供药品及伴随服务的国内药品生产企业、药品上市许可持有人、药品上市许可持有人(为境外企业)指定的进口药品全国总代理。(二)申报品种资格属于采购品种目录范围并获得国内有效注册批件的上市药品,且满足以下要求之一:1.原研药及国家药品监督管理局发布的仿制药质量和疗效一致性评价参比制剂。2.通过国家药品监督管理局仿制药质量和疗效一致性评价的仿制药品。3.根据《国家食品药品监督管理总局关于发布化学药品注册分类改革工作方案的公告》(2016年第51号)或《国家药监局关于发布化学药品注册分类及申报资料要求的通告》(2020年第44号),按化学药品注册分类批准,并证明质量和疗效与参比制剂一致的仿制药品。4.纳入《中国上市药品目录集》的药品。(三)其他申报要求1.申报的药品属于采购品种目录范围,且须对产能进行书面承诺。2.申报企业“供应清单”应包含采购品种目录内本企业生产的所有符合申报品种资格的规格和包装,若中选,未在供应清单内的产品不再挂网。3.同品种申报企业中,企业负责人为同一人,或存在直接控股、管理关系,或实际控制人为同一人的,视为同一企业,应提前申报并接受公示,不如实申报的,将按规定纳入医药价格和招采信用评价管理;若同时参与该品种申报,申报价格须一致,申报价格不一致的,取消申报资格。4.依据医药价格和招采信用评价制度,申报企业被列入当前《全国医药价格和招采失信企业风险警示名单》,或在联盟省份之一被评定为“特别严重”失信等级的,不得参加本次集中接续采购;在联盟省份之一被评定为“严重”失信等级的,相关品种不得参加本次接续采购(已修复的除外)。(四)企业报名方式本次联盟采购有关申报材料通过河南省医药采购平台(网址:http://yp.hnggzyjy.cn/HomePage/LogOn_New_ZB.aspx)进行网上申报。数字证书是企业网上申报的唯一标识。申报企业凭数字证书登录河南省医药采购平台进行网上药品申报、资料提交等相关操作。未申领数字证书的企业自行前往数字认证相关单位办理。企业注册方法见河南省医药采购平台--“办事指南”--“企业首次注册办理流程”。(五)报名需递交的材料1.申报企业资质材料(1)《企业营业执照》;(2)国内药品生产企业提供《药品生产许可证》,进口药品总代理企业提供《药品经营许可证》;(3)进口药品生产企业的《委托授权书》(仅进口药品总代理提供);(4)《法定代表人授权书》(附件1);(5)《药品申报企业承诺函》(附件2);(6)《企业关系申报表》盖章扫描件和电子版(附件3);(7)其他相关文件材料。2.申报产品资质材料(1)药品批准文号批件(药品批准文号批件证件名称为《药品注册批件》或者《药品再注册批件》,若有《药品注册补充申请批件》,请同时上传,以确保产品资质与实际情况相符;港、澳、台地区应提交《医药产品注册证》;进口药品应提交《进口药品注册证》);(2)《供应品种清单》盖章扫描件和电子版(见附件4);(3)《企业申报产品摸底调查表》盖章扫描件和电子版(见附件5);(4)药品符合“申报品种资格”的其他相关证明材料。3.材料提交各生产企业在规定时间内登录河南省公共资源交易中心网站“医药采购系统—招标平台—药品招标系统”,使用数字证书进行登录,点击“企业报名”模块,进行报名材料递交操作。(六)时间安排未注册企业申请账号时间:2022年11月27日前。办理CA数字证书时间:2022年11月27日前。企业提交报名材料时间:2022年11月22日--11月28日18:00。企业未在规定时间内提交,以及未按要求提交相关申报资料的,不得参与本次集中带量采购。三、采购文件征求意见根据联盟采购工作安排,现对《十六省(区、市、兵团)药品集中带量采购采购文件(征求意见稿)》向社会公开征求意见。如有意见建议,请于2022年11月24日17时前发送至hnsybjjgzc@126.com。
QQ工作群号:513855813十六省(区、市、兵团)联盟采购领导小组办公室(河南省医疗保障局代章)2022年11月21日
机构
-适应症
-靶点
-药物
-生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。


