预约演示
Nat. Chem. Biol. | 靶向BAX的共价抑制剂开发
Covalent inhibition of pro-apoptotic BAX,通讯作者是丹娜-法伯癌症中心的Loren D. Walensky教授,其课题组主要开发stapled peptides(订书肽)用于癌症治疗。这篇文章他们筛选出了一个BAX的共价配体,能够抑制其寡聚过程。

Preview
来源: 精准药物
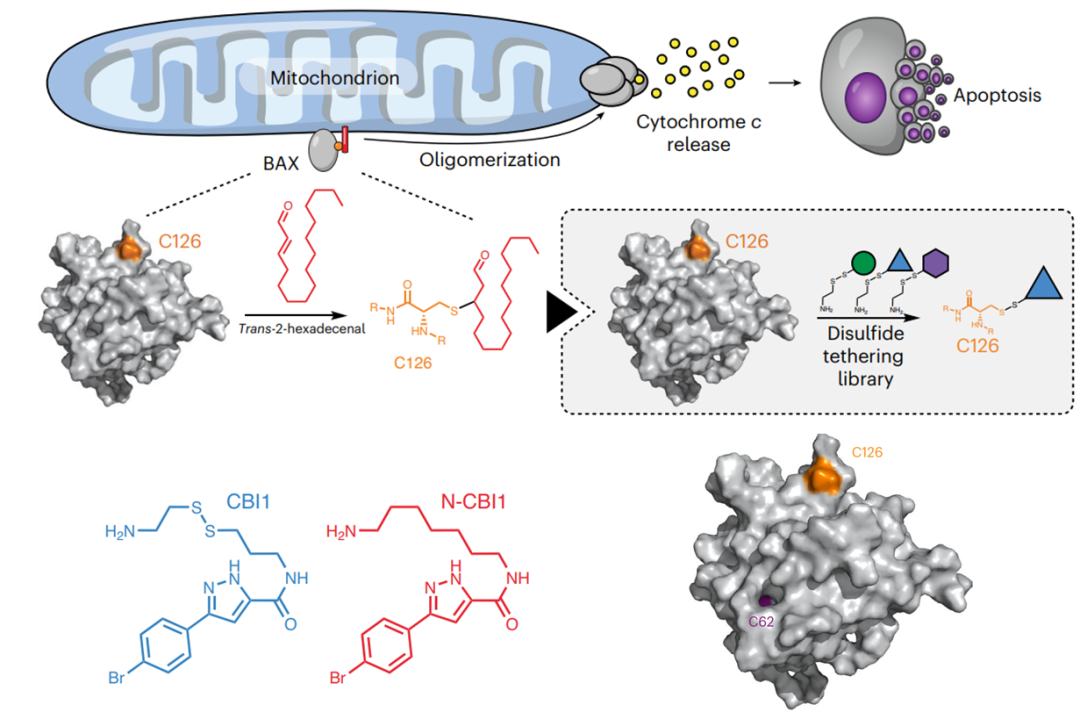
BAX蛋白能够诱导细胞凋亡,它在正常状态下以单体形式存在于细胞质中,当其被BH3激活发生构象变化后可发生寡聚,进而穿透并破坏线粒体外膜最终导致细胞死亡。除了被BH3激活外,BAX还可被(E)-2-十六烯醛(t-2-hex)激活,该激活过程依赖于t-2-hex对C126位的共价修饰进而导致的构象改变,因此作者希望基于这种机理筛选其它结合相同位点的共价配体,从而用于对BAX蛋白的功能调控。
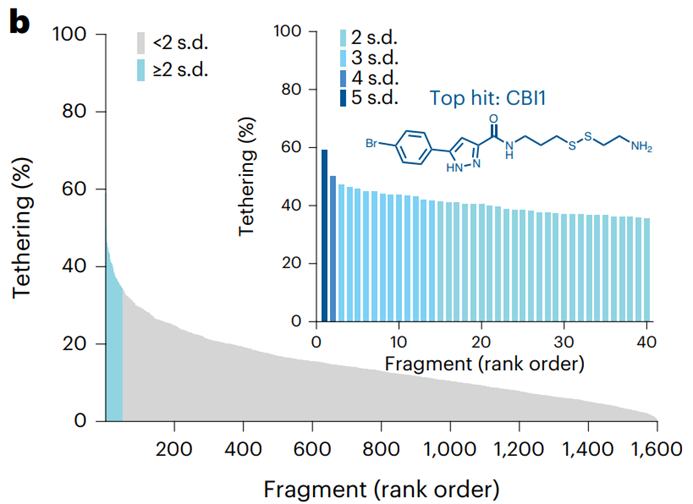
作者利用disulfide tethering(二硫化物捕获策略)对含有1600个含二硫键化合物的库进行了筛选,如果化合物能够与对应的结合区域存在非共价相互作用,即可在还原剂的存在下发生二硫键交换从而将化合物修饰到蛋白上,最后通过对整个蛋白进行LC-MS鉴定来确定修饰的存在。作者从中发现芳香氮杂环类物质有较好的结合能力,进一步的SAR优化最终确定化合物CBI1具有最佳的结合效果。
Preview
来源: 精准药物
通过在体外实验中模拟BAX激活后的膜穿透过程,作者发现,CBI1能够抑制BH3激活下BAX对膜的穿透效果,在CBI1浓度50μM时即可达到完全抑制,后续的点突变结果表明CBI1仅共价结合BAX的C126而不结合C62。作者进一步通过分子动力学模拟了二者的结合模式,并通过HMQC NMR分析了二者的结合过程,他们发现CBI1能够通过共价修饰C126来稳定结构中的α5和核心部分来维持BAX的单体结构,避免寡聚体的生成。为了确定CBI1与BAX的非共价作用对该过程的贡献,作者合成了一个不具有共价结合能力的CBI1类似物N-CBI1,并发现其影响化学位移的能力明显降低,说明共价结合在其中有很大贡献。
Preview
来源: 精准药物
在之前的研究中作者发现BAX的F116A突变体具有非常强的自激活活性,因此作者测试了CBI1是否能够抑制F116A突变体的自激活过程,他们在体外模型中发现1.5μM的CBI1即可完全抑制F116A突变体的自激活。类似地,该过程同样依赖于与Cys的共价结合。作者通过氢氘交换质谱进一步证实了CBI1同样可通过将F116A突变体维持在单体形式来避免其寡聚。
最后,作者对CBI1在内源t-2-hex存在下对BAX的影响进行了探究。作者推测CBI1除了能够稳定BAX的构象外,还能够竞争掉t-2-hex的修饰来发挥功能,他们发现在CBI1的加入下能够抑制t-2-hex的修饰并阻止BAX的二聚,而非共价的类似物N-CBI1的抑制效果则明显弱于CBI1,说明CBI1的确还能够通过竞争内源t-2-hex的方式来稳定BAX的单体构象。
总之,这篇文章筛选找到了BAX的共价配体CBI1,它能够稳定BAX的单体构象,并竞争内源激活剂t-2-hex来抑制BAX的寡聚。
原文链接:https://www.nature.com/articles/s41589-023-01537-6
内容来源于网络,如有侵权,请联系删除。
机构
-适应症
-靶点
药物
-生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。


