预约演示
项鹏/邓春华团队开发先导编辑+干细胞疗法,有望治疗男性不育
2023-09-19
细胞疗法临床研究
基于先导编辑的体外SLC编辑是一种有前景的遗传性原发性性腺功能减退症(HPH)治疗策略,并有望用于治疗多种生殖系统的遗传性疾病。
中山大学中山医学院项鹏团队联合中山大学附属第一医院邓春华团队,在 Advanced Science 期刊发表了题为:Precise Correction of Lhcgr Mutation in Stem Leydig Cells by Prime Editing Rescues Hereditary Primary Hypogonadism in Mice 的研究论文。
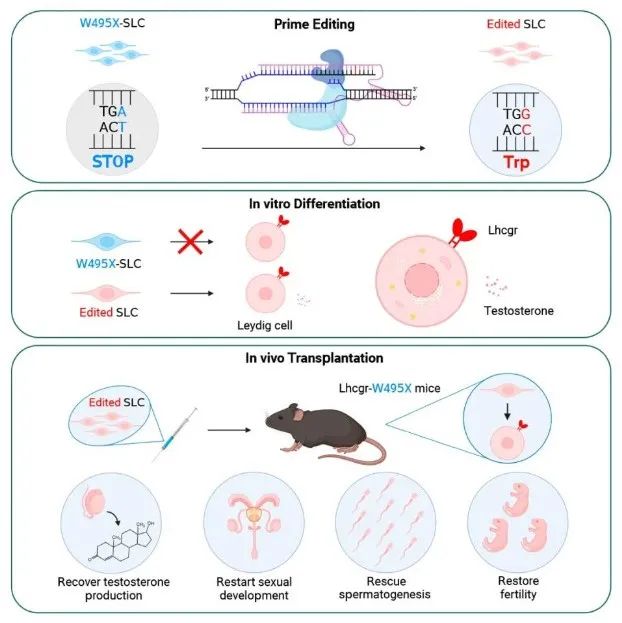
该研究首次通过先导编辑(PE)在体外修正了小鼠的睾丸间质干细胞(SLC)致病基因突变,将基因修正后的SLC移植到遗传性原发性性腺功能减退症(HPH)小鼠后可有效再生睾丸间质细胞(LC),进而恢复睾酮生成,重启性发育,挽救精子发生,并产生可育后代。
这些结果表明,基于先导编辑的体外SLC编辑是一种有前景的遗传性原发性性腺功能减退症(HPH)治疗策略,并有望用于治疗多种生殖系统的遗传性疾病。

Preview
来源: 生物谷
睾丸间质干细胞(Stem LeydigCell,SLC)能够通过增殖和分化再生新的睾丸间质细胞,在维持成年睾丸间质细胞稳态中发挥重要作用。项鹏/邓春华团队此前的研究发现,自体SLC移植可以提高非人灵长类动物模型的睾酮水平,改善精子发生,并改善原发性性腺功能减退症(PH)的相关症状。
最近的几项研究鉴定出具有克隆性、自我更新能力和多谱系分化潜能的人类SLC。更重要的是,人类SLC可在体外和体内分化为产生睾酮的功能性间质细胞。
这些研究结果表明,SLC移植是治疗男性原发性性腺功能减退症(PH)的有希望的治疗方法。然而,由于遗传性原发性性腺功能减退症(HPH)患者SLC存在遗传基因缺陷,因此,SLC移植无法实现治疗。
因此,如果在睾丸间质干细胞(SLC)中通过基因编辑技术来纠正致病基因突变,然后将编辑后的SLC用于自体移植,通过分化为有功能的睾丸间质细胞(LC),就能挽救遗传性原发性性腺功能减退症(HPH)。
在这项研究中,研究团队首先基于在HPH人类患者中观察到的Lhcgr无义点突变构建了LhcgrW495X突变小鼠模型。接下来,研究团队利用野生型小鼠的SLC(WT-SLC)评估了SLC移植治疗HPH的可行性。
研究团队进一步探索了不同基因组编辑工具对LhcgrW495X小鼠报告细胞和突变的SLC的编辑效率和脱靶效应。结果显示,先导编辑器——PEmax,对该突变的编辑效率最高,且没有明显的脱靶效应。
最后,研究团队评估了在体外经过基因编辑修正的SLC对HPH小鼠模型的治疗效果。为了评估PE-W495X-SLC移植后产生的精子是否可以支持生殖,研究团队在PE-W495X-SLC移植后6周,从雄性LhcgrW495X小鼠附睾尾获取的精子和从雌性野生型小鼠获取的卵母细胞进行了体外受精,成功产下36只子代小鼠。值得一提的是,这些子代小鼠具有正常生育能力。
Preview
来源: 生物谷
总的来说,该研究首次通过先导编辑(PE)在体外修正了LhcgrW495X小鼠的睾丸间质干细胞(SLC),将基因修正后的SLC移植到LhcgrW495X小鼠后可有效再生/p>
这些结果表明,基于先导编辑的体外SLC编辑是一种有前景的遗传性原发性性腺功能减退症(HPH)治疗策略,并有望用于治疗多种生殖系统的遗传性疾病。
更多内容,请访问原始网站
文中所述内容并不反映新药情报库及其所属公司任何意见及观点,如有版权侵扰或错误之处,请及时联系我们,我们会在24小时内配合处理。
药物
-生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。



