预约演示
更新于:2025-05-07
BET x p300-CBP transcription factors
更新于:2025-05-07
关联
1
项与 BET x p300-CBP transcription factors 相关的药物作用机制 BET抑制剂 [+1] |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段临床前 |
首次获批国家/地区- |
首次获批日期1800-01-20 |
100 项与 BET x p300-CBP transcription factors 相关的临床结果
登录后查看更多信息
100 项与 BET x p300-CBP transcription factors 相关的转化医学
登录后查看更多信息
0 项与 BET x p300-CBP transcription factors 相关的专利(医药)
登录后查看更多信息
102
项与 BET x p300-CBP transcription factors 相关的文献(医药)2025-05-01·European Journal of Medicinal Chemistry
Epigenetic targets and their inhibitors in the treatment of idiopathic pulmonary fibrosis
Review
作者: Wang, Xiujiang ; Miao, Xiaohui ; Li, Chunxin ; Liu, Pan ; Zhang, Wenying ; Liu, Yangyang
2025-02-13·Blood
Acute resistance to BET inhibitors remodels compensatory transcriptional programs via p300 coactivation
Article
作者: Guezguez, Borhane ; Agrawal-Singh, Shuchi ; Eleftheriadou, Ioanna ; Shah, Viral ; Yun, Haiyang ; Gallipoli, Paolo ; Tarkar, Aarti ; Schubert, Benedict ; Lugo, Dave ; Gallego-Crespo, Aaron ; Sasca, Daniel ; Prinjha, Rab K. ; Dhar, Arindam ; Osaki, Hikari ; Giotopoulos, George ; Huntly, Brian J. P. ; Horton, Sarah J. ; Kindler, Thomas ; Dawson, Mark A. ; Yeh, Paul ; Theobald, Matthias ; Haehnel, Patricia S. ; Behrendt, Malte A. ; Kühn, Michael W. M. ; Barbash, Olena ; Meduri, Eshwar ; Basheer, Faisal ; Meyerhöfer, Markus ; Saura-Pañella, Maria
2025-02-06·Blood
Preclinical efficacy of CDK7 inhibitor–based combinations against myeloproliferative neoplasms transformed to AML
Article
作者: Bhalla, Kapil N. ; Bose, Prithviraj ; Mill, Christopher P. ; DiNardo, Courtney ; Lin, Katie ; Das, Kaberi ; Masarova, Lucia ; Rampal, Raajit K. ; Jain, Antrix ; Hou, Hanxi ; Su, Xiaoping ; Pemmaraju, Naveen ; Loghavi, Sanam ; Fiskus, Warren ; Dunbar, Andrew ; Birdwell, Christine E. ; Matthews, Alicia ; Malovannaya, Anna ; Davis, John A. ; Alhamadani, Noor ; Philip, Kevin ; Flores, Lauren B. ; Manshouri, Taghi
9
项与 BET x p300-CBP transcription factors 相关的新闻(医药)2024-11-20
·药学进展
“
点击蓝字 关注我们
上海药物所构建基于化学空间互补的DEL数据构建小分子预测模型 PPS
2024年10月25日,中国科学院上海药物研究所陆晓杰课题组联合郑明月课题组合作在国际知名期刊Journal of Medicinal Chemistry上发表了题为“Enhancing the Predictive Power of Machine Learning Models through a Chemical Space Complementary DEL Screening Strategy”的研究论文。该研究提出通过整合亲和力筛选和光交联筛选,以增强DEL化合物库的“化学空间”多样性,同时,将DEL技术与人工智能(AI)相协同,共同促进药物的发现。
DEL技术具有高通量、操作简便、样品需求量少、筛选成本低、筛选流程快等特点,已成功用于发现多种治疗靶点的新型抑制剂,并成为首次寻找活性物质的合理选择。然而,DEL技术存在明显局限性,如较难实现功能性筛选,数据处理中存在假阳性信号,对化合物库质量要求高。
人工智能技术的兴起为各个领域带来了广泛的应用机会,尤其是在药物发现中, DEL技术展现了独特的优势。除了传统的亲和力筛选外,光交联筛选也是DEL筛选中常用的筛选方法,该方法不仅可以识别通过亲和筛选富集的高亲和力分子,还能发现那些通常被亲和筛选忽视的中等亲和力小分子。然而,与通常需要两到三轮洗脱的亲和筛选不同,光交联筛选仅进行一轮洗脱。这一限制降低了光交联筛选数据中富集信号的扩增效果,使得数据分析变得困难。因此,理论上将这两种方法结合起来,可以通过DEL分子更全面地表征靶点结合信息。这种互补性使得光交联筛选成为DEL筛选方法的一种强大补充。
在该项研究中,研究人员基于BRD4、p300和WDR5三种蛋白的DEL筛选数据,分别从数据化学空间互补性、训练模型的选择、联合模型及协同模型的建立等方面进行了研究探讨,最终基于具有化学空间互补性的两种DEL筛选数据,构建了针对特定蛋白的小分子预测模型,并成功发现了针对BRD4和p300靶标的先导化合物,展现出良好的药物开发潜力。这一成果为针对未充分探索的靶标提供了新的药物发现途径。
该研究策略为药物化学优化提供了一种新的思路,尤其在通过DEL筛选发现的活性化合物难以进一步优化时,为潜在药物候选物的开发与完善提供了机会。随着AI技术的快速进步,DEL技术将能够提供高通量且一致性良好的数据,特别是在未充分探索的靶标蛋白领域。DEL技术与AI的结合,为药物发现开辟了全新的、具有吸引力的研究方向。
上海药物所博士研究生索延瑞、苏州阿尔脉生物科技有限公司钱旭为该文的共同第一作者。上海药物所陆晓杰研究员、郑明月研究员为论文通讯作者。该研究得到国家自然科学基金、国家重点研发计划等项目的资助。
文章来源:上海药物所
美编排版:覃冰冰
文章审核:覃冰冰 罗琪
【免责声明】以上内容来源于互联网,不代表本平台立场或观点;如有侵犯作者著作权,请及时与我们联系(Tel:025-83271227,或直接在微信平台留言),我们将及时更正或删除。
《药学进展》杂志由中国药科大学和中国药学会共同主办、国家教育部主管,中国科技核心期刊(中国科技论文统计源期刊)。刊物以反映药学科研领域的新方法、新成果、新进展、新趋势为宗旨,以综述、评述、行业发展报告为特色,以药学学科进展、技术进展、新药研发各环节技术信息为重点,是一本专注于医药科技前沿与产业动态的专业媒体。
《药学进展》注重内容策划、加强组稿约稿、深度挖掘、分析药学信息资源、在药学学科进展、科研思路方法、靶点机制探讨、新药研发报告、临床用药分析、国际医药前沿等方面初具特色;特别是医药信息内容以科学前沿与国家战略需求相合,更加突出前瞻性、权威性、时效性、新颖性、系统性、实战性。根据最新统计数据,刊物篇均下载率连续三年蝉联我国医药期刊榜首,复合影响因子1.216,具有较高的影响力。
《药学进展》编委会由国家重大专项化学药总师陈凯先院士担任主编,编委由新药研发技术链政府监管部门、高校科研院所、制药企业、临床医院、CRO、金融资本及知识产权相关机构近两百位极具影响力的专家组成。
联系《药学进展》↓↓↓
编辑部官网:pps.cpu.edu.cn;
邮箱:yxjz@163.com;
电话:025-83271227。
欢迎投稿、订阅!
往期推荐
聚焦“兴药为民·2023生物医药创新融合发展大会”“兴药为民·2023生物医药创新融合发展大会”盛大启幕!院士专家齐聚杭城,绘就生物医药前沿赛道新蓝图“兴药强刊”青年学者论坛暨《药学进展》第二届青年编委会议成功召开“兴药为民·2023生物医药创新融合发展大会”路演专场圆满收官!校企合作新旅程已启航
我知道你在看哟
2024-07-24
·生物谷
近日,一篇发表在国际杂志Cell上题为“Progestogen-driven B7-H4 contributes to onco-fetal immune tolerance”的研究报告中,来自密歇根大学医学院等机构的科学家们探索了癌症与怀孕中免疫耐受机制的共通之处,为理解癌症如何逃避宿主免疫系统监视提供了崭新视角。
研究者Weiping Zou博士表示,在怀孕期间,宿主机体的免疫系统并不会排斥生长中的胎儿,所以我们知道胎盘中或许存在一种活跃的机制。同样的,在癌症中也是相似的道理——生长中的肿瘤并不会被宿主机体的免疫系统所排斥,这就意味着,癌细胞会产生一些策略来抑制免疫排斥,就像怀孕一样。当然,在怀孕期间,这是一件好事,其能促使胎儿生长;但在癌症中,却导致肿瘤不受控地生长,并且使刺激免疫反应的疗法效果受限。
为了理解这种重叠性,来自免疫学、癌症遗传学、妇科病理学和药物化学方面的研究人员进行了联合研究。他们发现,癌症与怀孕确实共享一种名为B7-H4的免疫抑制机制,阻断这一机制能显著增强免疫系统对癌症的抑制作用。通过观察小鼠模型和乳腺癌及妇科癌症细胞系,研究人员发现,孕激素作为B7-H4免疫检查点的关键调控因子,扮演着核心角色。
科学家发现人类怀孕和癌症发生之间共同的特殊免疫机制
图片来源:Cell (2024). DOI:10.1016/j.cell.2024.06.012
此前研究已发现,B7-H4高表达与癌症患者预后较差相关,而本研究进一步证实,B7-H4在胎盘和肿瘤微环境中调控免疫系统方面发挥着重要作用。此外,尽管雄激素在前列腺癌免疫抑制中的作用已得到确认,但本研究首次揭示,孕激素也可能影响癌症中的免疫反应。
通过抑制剂阻断乳腺癌小鼠及人类乳腺癌组织样本中的孕激素信号,研究者观察到癌症生长减缓及免疫反应激活的现象,尽管效果显著,但并未引起广泛关注。
Zou博士表示,B7-H4是一个复杂的检查点,孕激素调节只是众多机制之一,需要进一步研究来揭示是否存在其它调控B7-H4的机制。目前,研究人员仍然有一些不了解的东西,例如,如何直接阻断B7-H4这一信号通路?其作用的受体有哪些?下一步研究人员计划深入研究调节B7-H4蛋白稳定性的机制。以及是否存在其它在癌症免疫学中发挥关键作用的因素。
综上,本研究不仅揭示了女性孕激素通过B7-H4在癌症-胎儿免疫耐受中的生物学关联,还发现了PR-P300-BRD4轴作为治疗B7-H4癌症的潜在靶点,为癌症免疫治疗开辟了新的研究方向。
参考文献:
Jiali Yu, Yijian Yan, Shasha Li, et al. Progestogen-driven B7-H4 contributes to onco-fetal immune tolerance, Cell (2024). DOI:10.1016/j.cell.2024.06.012
本文仅用于学术分享,转载请注明出处。若有侵权,请联系微信:bioonSir 删除或修改!
点击下方「阅读原文」,前往生物谷官网查询更多生物相关资讯~
免疫疗法
2024-07-10
·奇点网
*仅供医学专业人士阅读参考
提问:癌症和妊娠之间有什么关系?实话说,奇点糕的第一反应还是多年前在临床上,见到过的几例孕期确诊癌症的患者,但从癌症和免疫的角度去想,答案就完全不一样了:妊娠过程中存在母-胎免疫耐受,而癌细胞逃避免疫系统的追杀也是免疫耐受,近年来学界已经揭示了多个癌症与妊娠共享的免疫耐受机制和调控通路[1],但还有不少机制藏在水下。
近日,密歇根大学邹伟平教授团队主导、耶鲁大学陈列平教授等研究者参与的一项最新研究成果登上了《细胞》,首次揭示免疫检查点分子B7-H4也参与了癌胚免疫耐受(Onco-fetal immune tolerance):B7-H4的表达水平会受孕激素调控,并通过抑制CD8+T细胞激活和促耗竭帮助乳腺癌进展,研究还找到了调控上述进程的PR-P300-BRD4信号轴[2]。
论文核心机制总结
研究者们首先分析了14个不同肿瘤的单细胞RNA测序数据集,重点评估MHC分子、B7家族成员和肿瘤坏死因子(TNF)家族成员在癌细胞和滋养层细胞(胎盘主要成分)的表达特点,而B7-H4就是癌细胞表达水平最高、胎盘滋养层细胞表达水平第二高的基因,且乳腺癌、卵巢癌、子宫内膜癌等源自女性生殖器官的癌症中表达更是高得非常突出。
而对孕早期人体滋养层细胞转录组学的分析也显示,滋养层细胞会同时表达HLA-G和B7-H4,在小鼠胎盘中也是如此,且母体和胎儿起源的细胞和组织中均有B7-H4表达。结合B7-H4此前被推定的免疫抑制功能,研究者们初步猜测B7-H4是癌胚免疫耐受检查点,并通过小鼠实验来明确B7-H4的实际功能。
敲除雌性小鼠的B7-H4,并构建异基因交配模型后,研究者们观察到敲除B7-H4小鼠的胚胎吸收较未敲除小鼠更多,且胎盘及被吸收胚胎周围的蜕膜区域T细胞浸润显著增多,提示T细胞激活的标志物(如CD25/44/69)和多种趋化因子、细胞因子(如IFN-γ、TNF-α)水平也明显上升,说明B7-H4对异基因交配相关的免疫激活有调节作用。
进一步实验显示,CD8+T细胞对敲除B7-H4小鼠的胚胎吸收至关重要,而表达B7-H4的绒毛外滋养层细胞(EVTs)或是通过约束CD8+T细胞,使正常的母-胎免疫耐受能够存在,因此B7-H4起到了重要的保护作用,但放到癌症场景中情况就不同了。结合前面的实验,研究者们推测B7-H4在胎盘和癌症中的表达水平,可能受某种女性特有激素的调控。
B7-H4能调节母-胎免疫耐受
研究者们用三类不同的女性激素,即性激素(雌激素/孕激素)、妊娠相关激素(如绒毛膜促性腺激素/hCG)和月经周期相关激素(如卵泡刺激素/FSH)分别处理了乳腺癌细胞,发现仅有孕激素(孕酮)或孕酮受体激动剂处理可显著上调癌细胞的B7-H4表达,处理滋养层细胞和卵巢癌细胞的结果也是一样,但前列腺癌细胞或PD-L1表达就不会受孕酮影响。
而与此前小鼠交配模型中的现象一致,癌细胞的B7-H4表达被孕酮上调后,B7-H4就会抑制CD8+T细胞的抗肿瘤功能,加速乳腺癌在小鼠身上的进展,这种效应同时体现在两个方面,一方面是CD8+T细胞的增殖能力、细胞毒性功能都明显减弱,另一方面则是耗竭CD8+T细胞的占比明显上升。下一个问题就呼之欲出了:孕酮是怎么调控B7-H4表达的呢?
孕酮上调B7-H4表达对抗肿瘤免疫有显著的不利影响
分析显示,被孕酮激活的孕激素受体(PR)会结合到B7-H4基因上游的-58 kb区域,该区域在女性生殖器官来源恶性肿瘤细胞和滋养层细胞中都相当活跃,具有显著的增强子特征,还可以与启动子区域直接发生相互作用,将该区域删除就能阻断孕酮处理对B7-H4表达的影响。此外,孕酮对B7-H4表达的影响还需要依赖表观遗传调控,关键的调节因子是组蛋白乙酰转移酶P300和“表观遗传阅读器”之一的溴结构域蛋白4(BRD4)。
孕酮结合到-58 kb增强子区域,是调控B7-H4表达的关键步骤
最后,研究者们评估了靶向B7-H4调节轴对免疫治疗的潜在影响:使用PR拮抗剂或BRD4降解剂来阻断孕酮对B7-H4表达水平的调节,都能够与PD-L1抑制剂实现协同增效,更好地抑制乳腺癌进展,对于存在B7-H4高表达的肿瘤,这套联合治疗方案或许是破解肿瘤微环境免疫抑制、改善疗效的全新选择,说不定就能攻破卵巢癌这样的免疫难治肿瘤呢。
参考文献:
[1]Kareva I. Immune suppression in pregnancy and cancer: parallels and insights[J]. Translational Oncology, 2020, 13(7): 100759.
[2]Yu J, Yan Y, Li S, et al. Progestogen-driven B7-H4 contributes to onco-fetal immune tolerance[J]. Cell, 2024.
本文作者丨谭硕
临床研究
分析
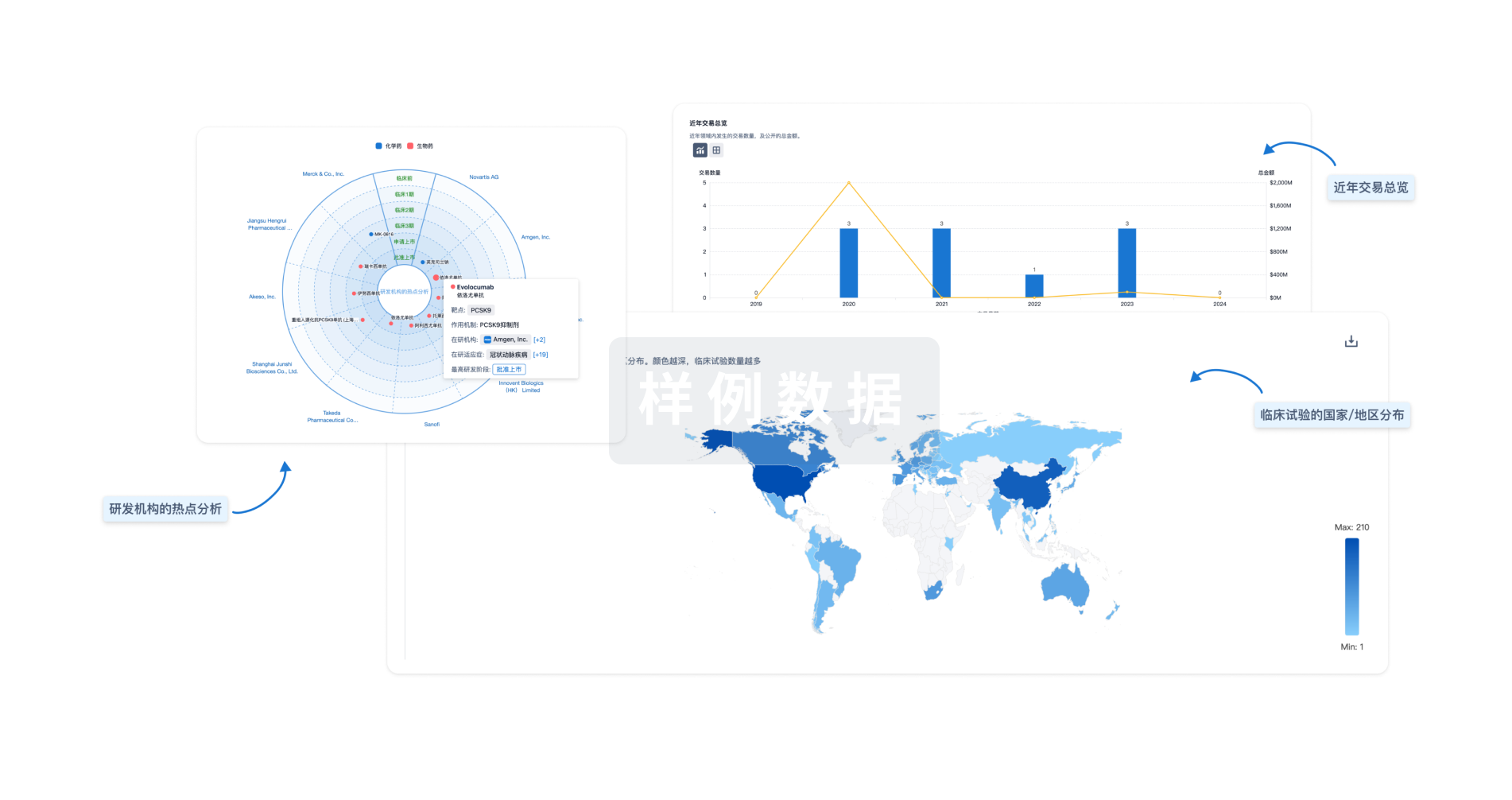
对领域进行一次全面的分析。
登录
或
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用
