AXS-05 or氯胺酮,谁是抑郁症更优选择?
抗抑郁药物的分类方法大致可以分为以下几类:选择性5-HT再摄取抑制剂(SSRIs)、5-HT与NE再摄取抑制剂、NaSSA、NDRI、褪黑素受体激动剂等属于一线用药。而SARI、NARI、SSRA、TCAS等则属于二线用药。然而,目前的抗抑郁药物往往在治疗效果上有延迟,并且伴随着严重的副作用。对于大多数重度抑郁症患者而言,单胺为靶点的一线或二线治疗往往无法达到足够的治疗效果。
在2019年,美国FDA批准了艾氯胺酮用于治疗难治性抑郁症。艾氯胺酮展现出快速且强效的抗抑郁作用,给予患者带来了新的希望,并引发了对快速起效和替代作用机制药物的需求。而在2022年8月19日,AXS-05也获得了批准上市,属于同类药物,相较于艾氯胺酮,它具备一些优势。右美沙芬具有与艾氯胺酮相似的药理特性,当与安非他酮联合使用时,二者具有协同治疗效果。安非他酮通过与神经转运体NET和多巴胺转运体DAT结合发挥作用,并对CYP450 2D6具有抑制作用,可以提高右美沙芬的口服生物利用度。
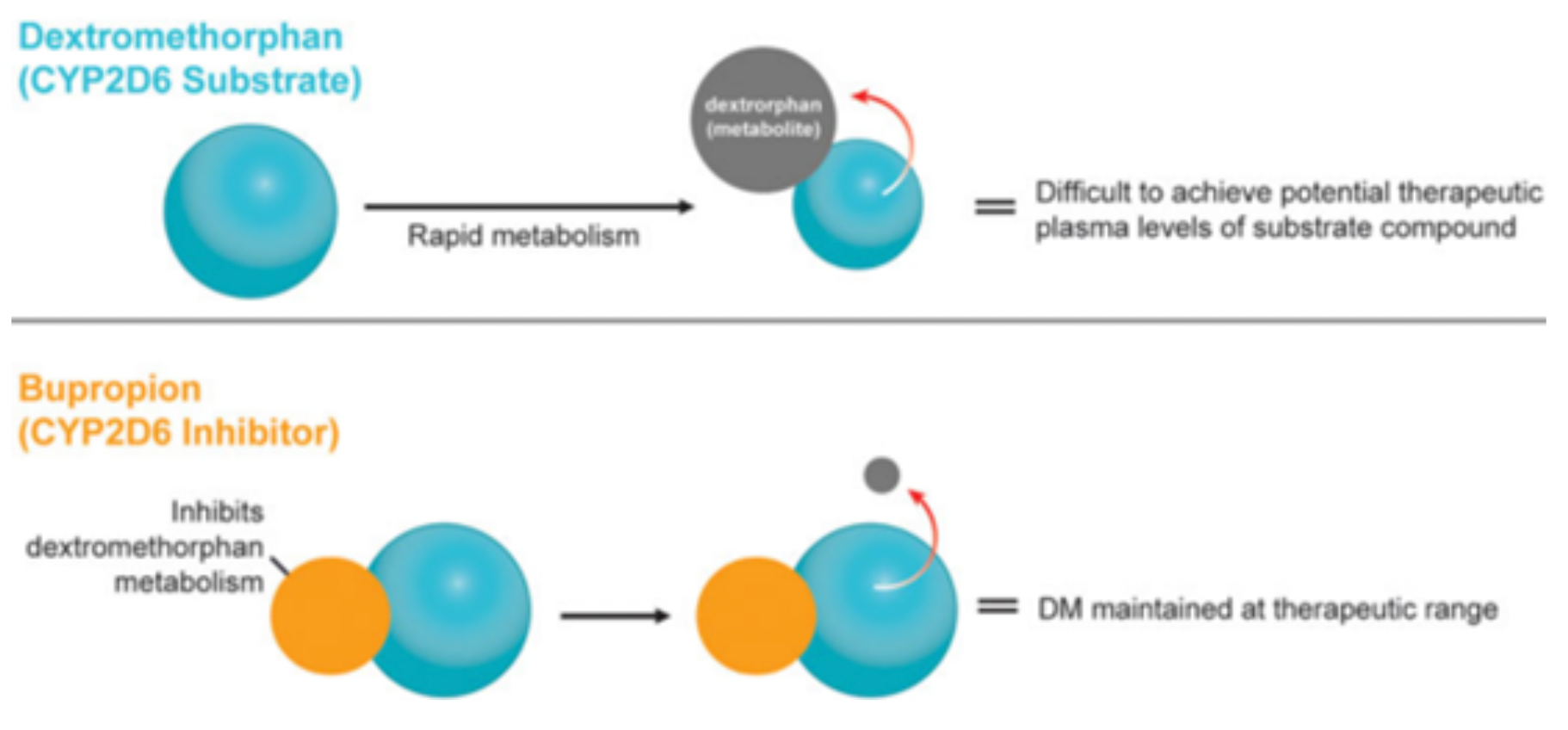
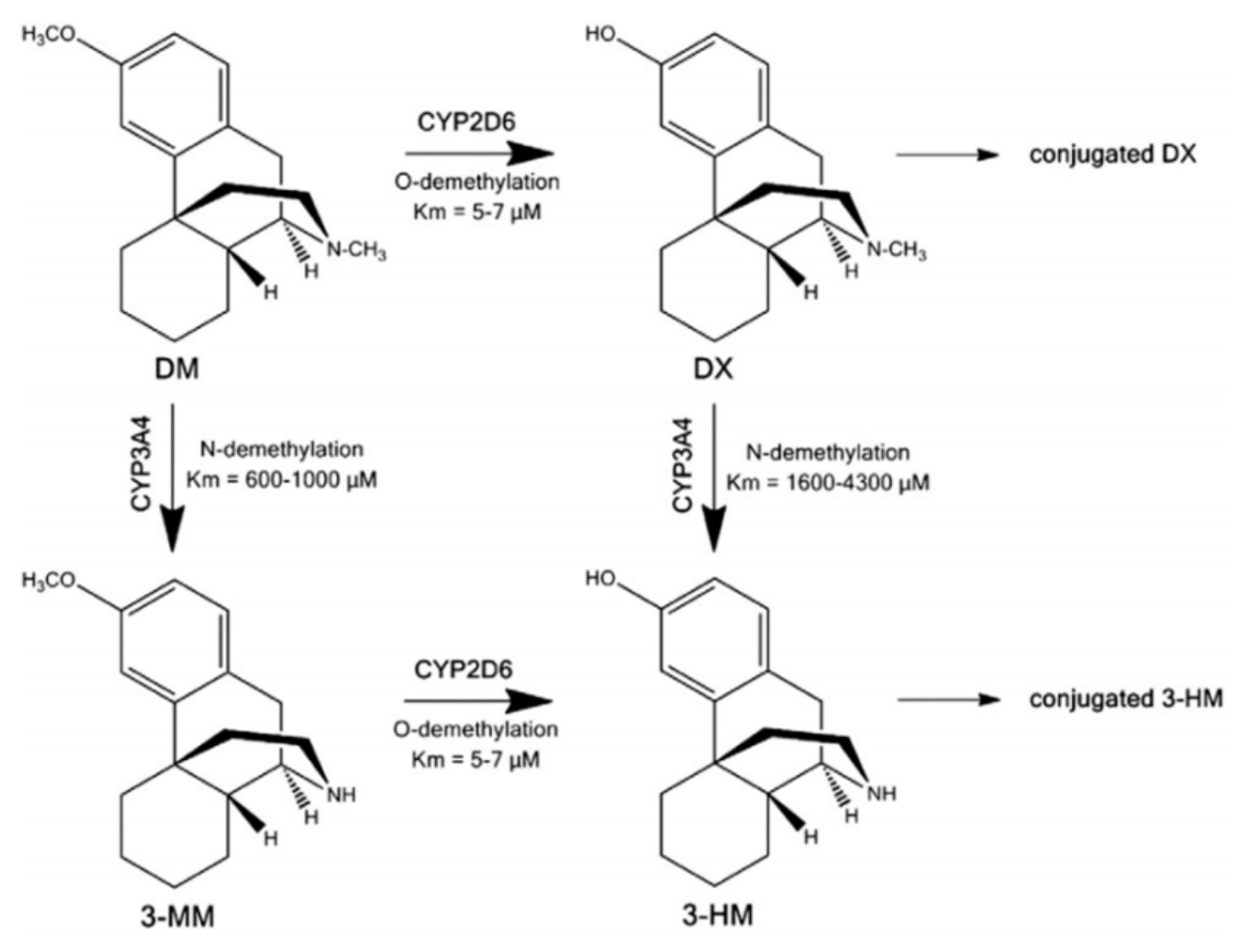
AXS-05是一种复方药物,由45mg的右美沙芬和105mg的安非他酮组成。右美沙芬主要被认为是一种NMDA拮抗剂,而安非他酮则是一种去甲肾上腺素-多巴胺再摄取抑制剂。安非他酮及其代谢物均属于CYP2D6抑制剂,而右美沙芬则是CYP2D6代谢酶的底物。根据图2的数据可以看出,安非他酮通过抑制CYP2D6代谢酶,可以减少右美沙芬的去甲基代谢途径,从而降低主要代谢产物3-HM的浓度,而3-HM并不具有药理活性。同时,这也减少了右美沙芬的II相代谢。在临床研究中,安非他酮与右美沙芬联合使用确实使得右美沙芬的血浆暴露量在所有评估剂量组中显著增加。安非他酮具有独特的中枢作用机制,不仅是右美沙芬代谢抑制剂,而且在广泛的神经精神疾病(如抗抑郁症)中具有与右美沙芬协同作用的药理效应。除了获得重度抑郁症的批准外,AXS-05还在进行其他两个适应症的临床三期(躁动)和二期(戒烟)研究。
抑郁症是一种常见的慢性、严重的精神疾病,其主要特征包括持续的心境低落、睡眠障碍、食欲紊乱和社交恐惧等。全球范围内抑郁症患者超过3亿人,每年有近80万人因抑郁症而自杀身亡。抑郁症所占的非致命性疾病总负担约占全球的10%,导致的残疾损失年数超过其他疾病。因此,抑郁症给人类的身体健康和经济产生了巨大的负面影响。[4]
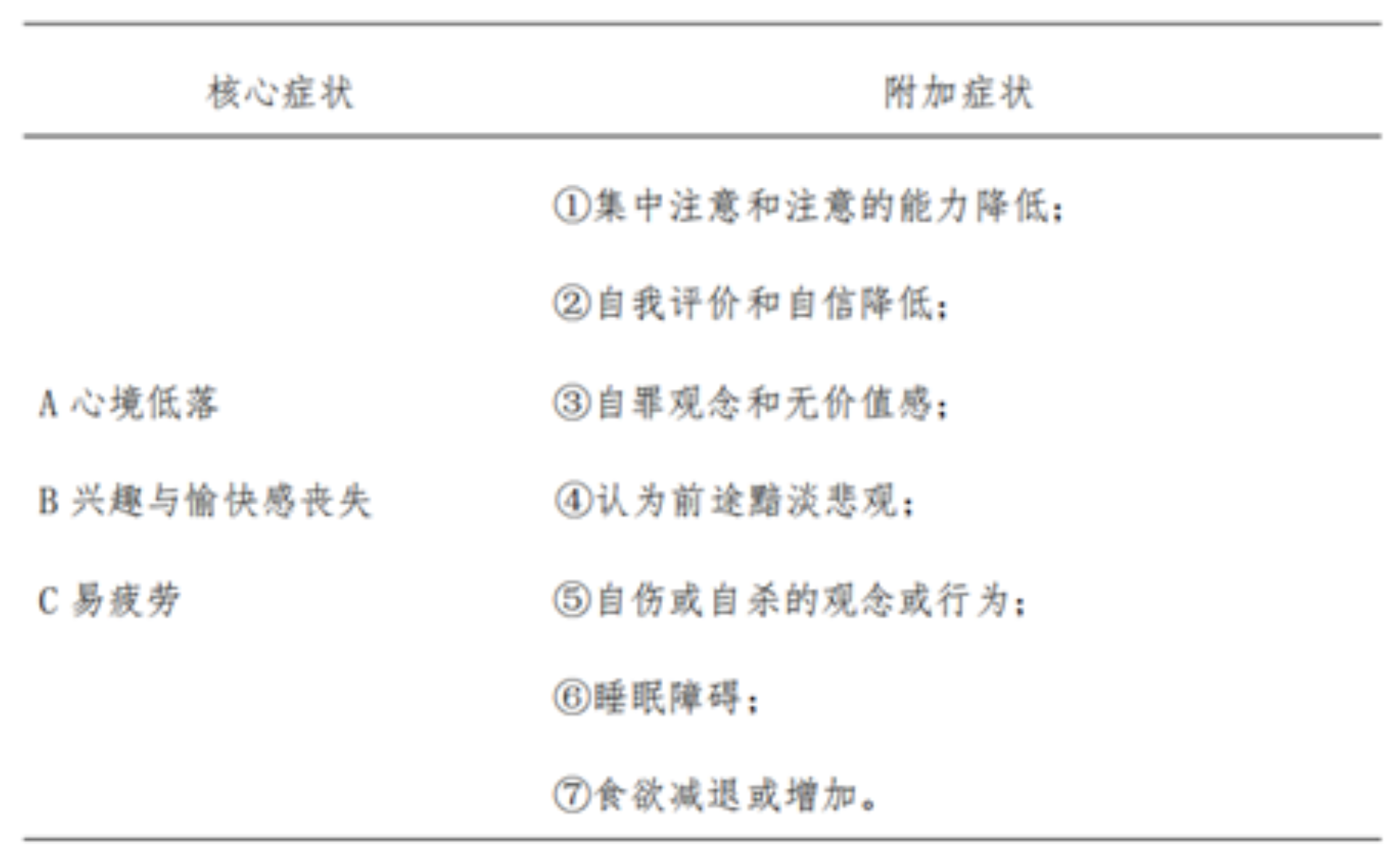
抑郁症的诊断依据最新发布的《精神障碍诊疗规范(2020年版)》中关于抑郁障碍的诊断标准。根据这一标准,如果一个人具备了低落情绪、兴趣和愉悦感丧失以及易疲劳等核心症状,并伴随着注意力下降、自我评价降低、负罪感、对未来持悲观态度、自杀倾向、失眠、食欲改变等附加症状中的至少两项,并且这些症状持续时间超过2周,那么可以明确诊断为抑郁症。[5]
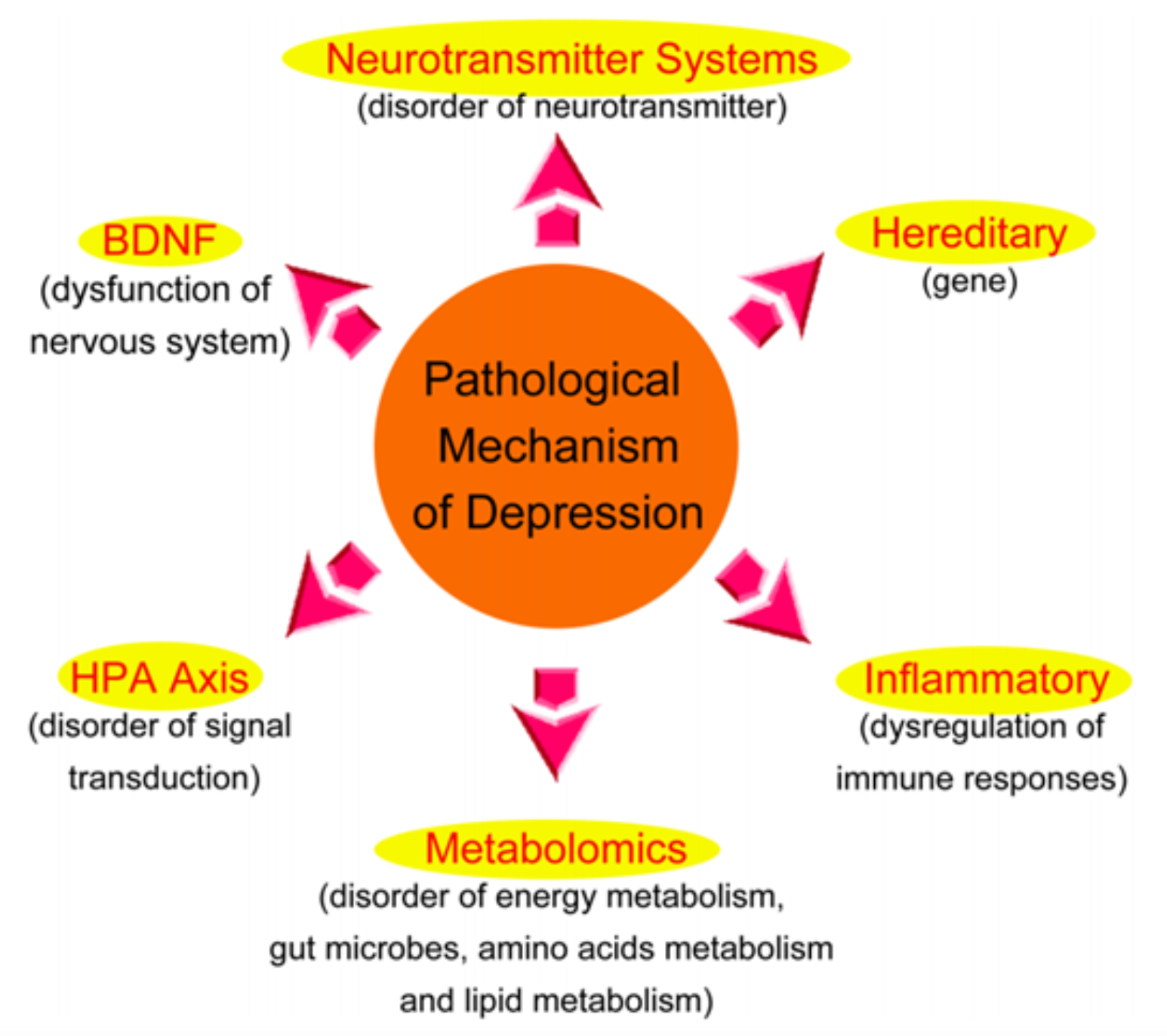
抑郁症的发病机制 [4]:1. 遗传因素:重性抑郁症的遗传概率可能在31%至42%之间,而复发性重性抑郁症的遗传水平可能更高;2. 神经递质系统:单胺类假说认为,5-羟色胺(5-HT)和多巴胺(DA)等单胺类神经递质浓度的降低是导致抑郁症发生的主要原因之一;3. 神经营养因子假说:该假说认为,神经营养因子,尤其是脑源性神经营养因子(BDNF)的表达和功能下调可能导致情绪抑郁,从而引发抑郁症。BDNF是中枢神经系统中一种重要的神经营养因子,在神经元的生长和存活过程中发挥关键作用。研究发现,自杀的抑郁症患者大脑海马区的BDNF水平明显下降,而接受抗抑郁治疗的自杀患者大脑区域的BDNF表达量显著增加;4. 下丘脑-垂体-肾上腺轴(HPA):HPA是一种重要的内分泌轴,能够维持内稳态和应激反应,并具有重要的调节功能。它控制着多种调节肽和激素的分泌,在抑郁症的发生和发展中起着独特的作用。临床研究发现,患有抑郁症的患者常常表现出HPA功能亢进的特征;5. 炎症因素:抑郁症患者体内常伴有肿瘤坏死因子-α(TNF-α)等炎症因子的升高和抗炎因子的降低。而给予抗抑郁药物治疗后,患者体内炎症因子水平明显降低,抗炎因子水平明显升高;6. 兴奋性氨基酸假说:兴奋性氨基酸系统,尤其是代谢型谷氨酸受体系统和γ-氨基丁酸受体系统,可能参与抑郁症的发病过程。谷氨酸是中枢神经系统中重要的兴奋性氨基酸,也是海马区中一个关键的神经递质。研究显示,抑郁症患者血浆中代谢型谷氨酸水平明显升高,脑脊液中代谢型谷氨酸水平也明显升高。致病机制可能是代谢型谷氨酸水平过高激活了神经元细胞膜上的N-甲基-D-天冬氨酸受体(NMDA),导致钙离子通道开放,大量钙离子内流,细胞内钙超载,进而导致神经元变性甚至死亡。
抗抑郁相关药物的研究近年来取得了快速的进展,针对抑郁症的发病机制和特异性治疗靶点进行了深入研究。根据不同的结构类型,抗抑郁药物大致可以分为以下几类:选择性的5-HT再摄取抑制剂(SSRIs)、5-HT与NE再摄取抑制剂、NaSSA、NDRI、褪黑素受体激动剂等一线用药,以及SARI、NARI、SSRA、TCAS等二线用药。
经典的抑郁症单胺假说认为,抑郁症是由于单胺神经递质的缺乏所致。虽然缺乏直接证据支持单胺假说,但几乎所有目前存在的抗抑郁药物都直接影响一个或多个单胺神经递质系统。然而,尽管这类药物在开始治疗后会增加单胺水平,但治疗效果往往需要数周的时间才能显现。
因此,研究的重点已经从神经递质本身转移到了受体和这些受体所引发的下游信号,以解释抗抑郁药物的作用机制。抗抑郁药物介导的神经发生和神经可塑性的改变引起了越来越多的关注。针对单胺通路的药物治疗,如选择性5-羟色胺再摄取抑制剂(SSRIs),已经证明可以增加海马齿状回的神经发生。这些作用可能通过激活环磷酸腺苷(cAMP)反应元件结合蛋白(CREB)介导,而CREB可以调控许多与神经可塑性相关的基因表达,包括脑源性神经营养因子(BDNF)。临床研究显示,长期抗抑郁药物治疗可以恢复异常低下的BDNF水平,而这种恢复与抑郁评分的降低有关。
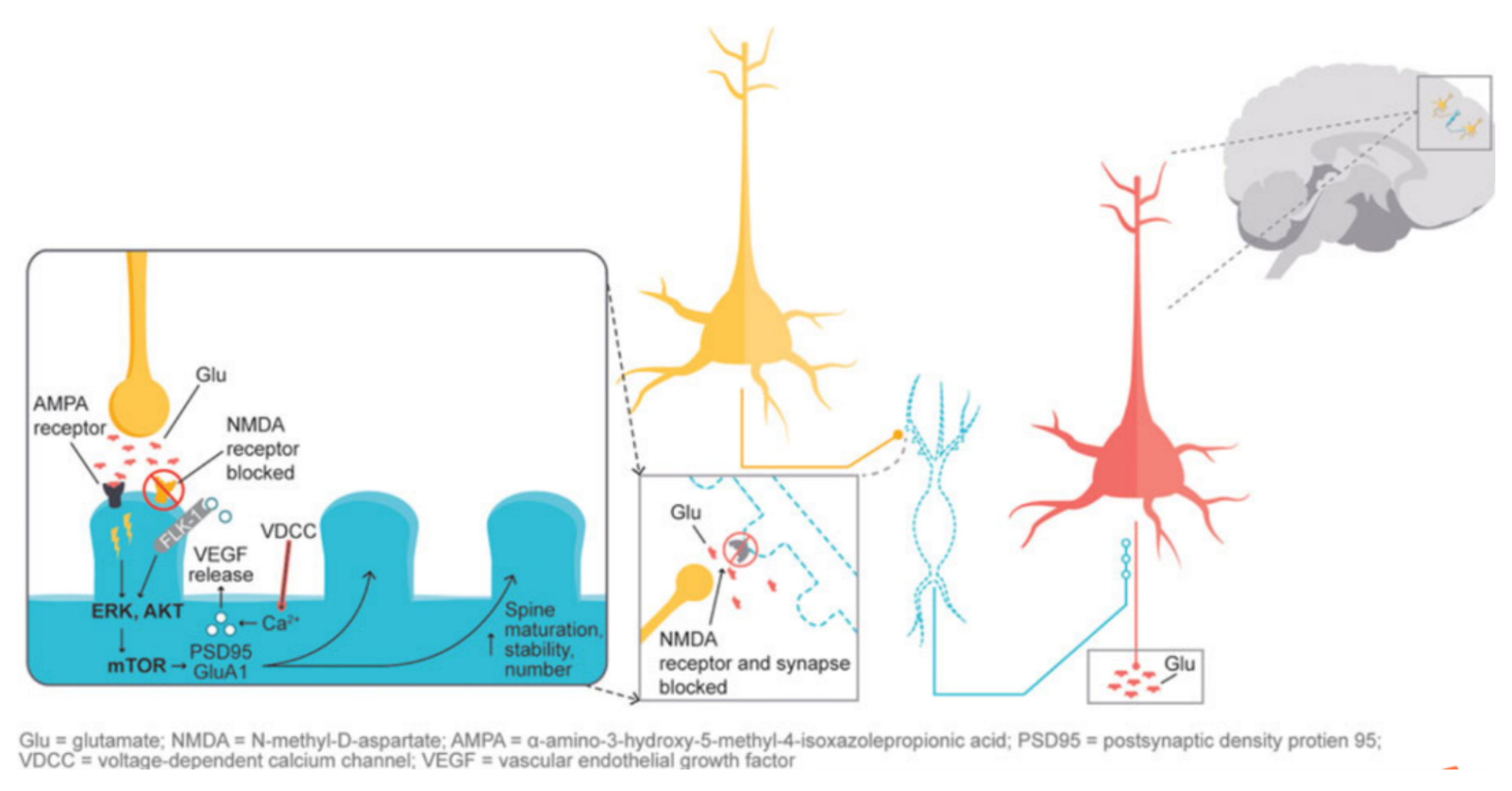
此外,在前面提到的兴奋性氨基酸假说中,谷氨酸信号传导被认为在维持神经可塑性方面发挥重要作用。当谷氨酸介导的AMPA受体被激活时,会导致细胞外信号调节激酶/蛋白激酶B的激活,或者ERK/AKT信号转导级联,从而触发mTOR通路的激活。而mTOR通路的激活可以增加突触蛋白的表达,进而增加树突棘的密度。通过氯胺酮刺激的突触和细胞内事件研究表明,NMDA拮抗产生了“谷氨酸激增”,然后增加了AMPA/NMDA受体的通量,从而刺激了细胞内信号级联。研究表明,氯胺酮和右美沙芬在发挥抗抑郁作用时都需要激活AMPA受体。图4展示了NMDA阻断介导的AMPA受体激活所诱导的参与神经可塑性的下游级联反应,这被认为是抗抑郁作用的基础。
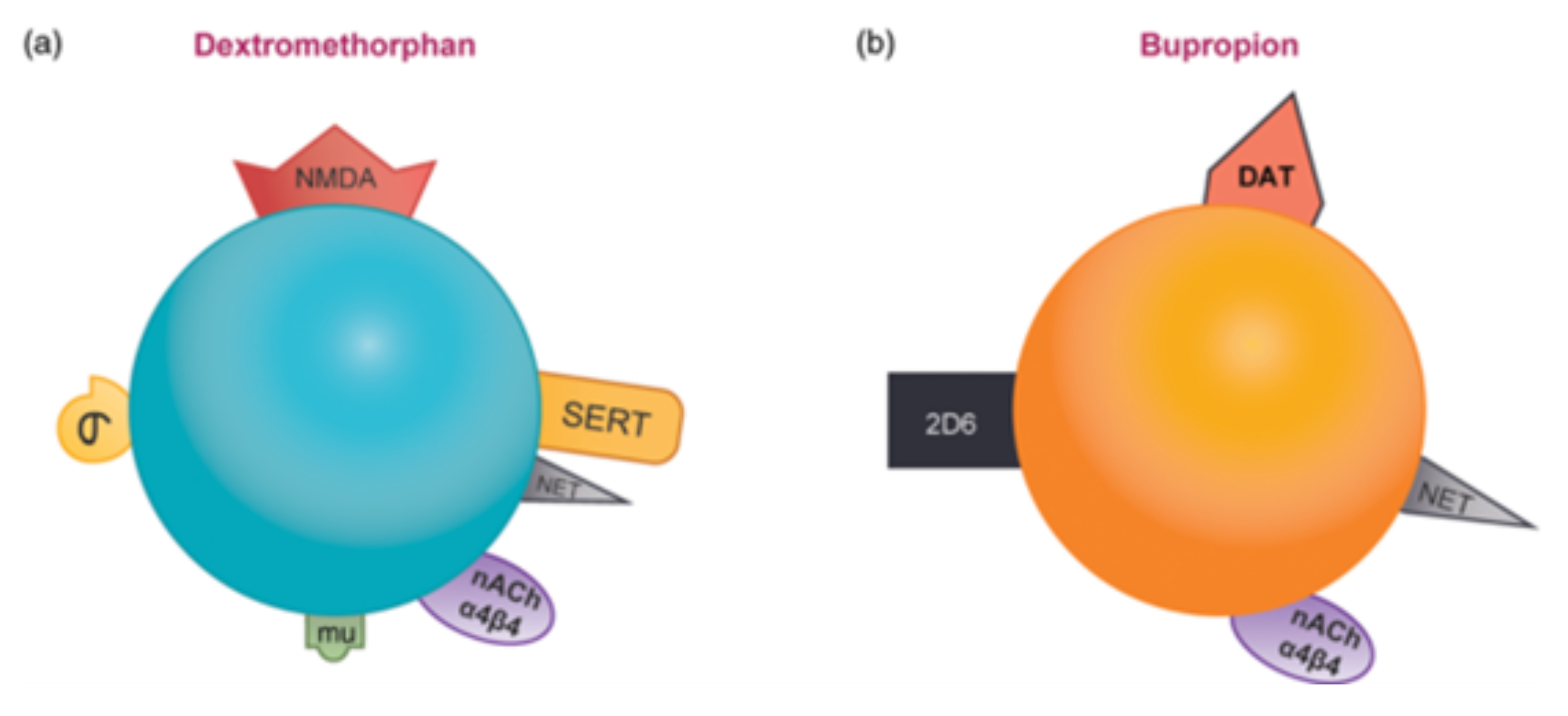
右美沙芬/安非他酮将几种不同的抗抑郁治疗类的作用机制结合成一种治疗剂。右美沙芬和安非他酮都通过抑制再摄取来增加去甲肾上腺素的浓度,同时也都是α4β4的nACh的拮抗剂。此外,安非他酮通过阻断再摄取来增加多巴胺的浓度,而右美沙芬通过作为NMDA受体拮抗剂和5-羟色胺的增加来增加谷氨酸的浓度。右美沙芬(图5A)是一种NMDA受体拮抗剂,同时也是SERT和NET的抑制剂、nACh α4β4拮抗剂,以及sigma-1和mu阿片受体的激动剂。安非他酮(图5B)是一种CYP2D6的抑制剂,同时也是NET和DAT的抑制剂以及α4β4型尼古丁酸乙酰胆碱受体的拮抗剂。
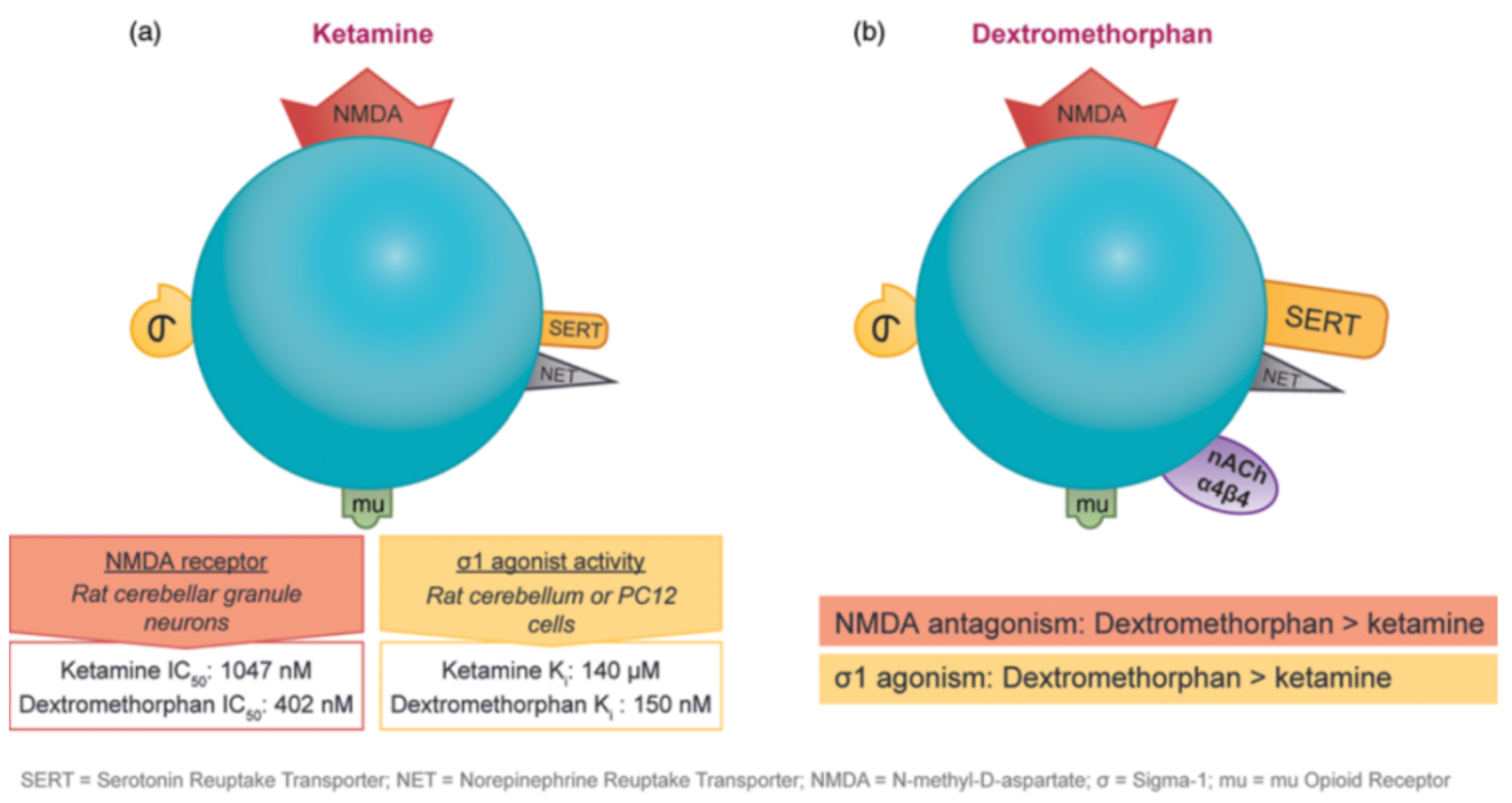
亚麻醉剂量的氯胺酮对于难治的单极或双极抑郁症患者具有立即的抗抑郁作用,这一观察结果引发了人们对具有类似药物机制的药物的探索。氯胺酮和右美沙芬在相同的受体上展示了活性,并且在某些细胞测试系统中,右美沙芬作为NMDA受体拮抗剂表现出更高的亲和力和对sigma-1受体的更强激动作用。如图6(a)所示,氯胺酮作为NMDA受体拮抗剂的IC50为1047 nM,而右美沙芬的IC50为402 nM,提高了2.5倍;而对于sigma-1受体的激动作用,氯胺酮的Ki为140 μM,而右美沙芬的Ki为150 nM,提高了近1000倍。
有趣的是,在给成人耐药抑郁症患者静脉注射氯胺酮之前,纳曲酮的阿片受体拮抗作用减弱了氯胺酮的抗抑郁作用(但不减弱解离作用)。这表明氯胺酮的急性抗抑郁作用需要阿片激活,但解离作用不需要。一种解释是,阿片受体介导的信号传导和NMDA受体介导的信号传导之间的串扰干扰了氯胺酮激活mTOR的能力。然而,在氯胺酮输注前使用mTOR抑制剂雷帕霉素可增强对患者的治疗,并没有阻断氯胺酮的抗抑郁作用。因此,需要进一步研究来充分阐明阿片信号通路在氯胺酮抗抑郁作用中的作用。
值得一提的是,通过右美沙芬和CYP2D6代谢酶抑制剂组成复方上市,AXS-05并不是第一个。以右美沙芬/奎尼丁为主要成分的复方药物AVP-923,作为孤儿药,于2010年10月被FDA批准用于治疗假性延髓情绪(pseudobulbar affect,PBA)[3]。奎尼丁主要用于抗心律失常,临床剂量为200-300mg,对CYP2D6是可逆抑制剂。然而,有报道指出,由于加入了奎尼丁,AVP-923[7]存在心毒性。而AVP-786[8]是奎尼丁用量减半并使用氘代右美沙芬的复方药物,氘代右美沙芬可以封闭代谢位点,有利于在奎尼丁用量减少的基础上维持右美沙芬的暴露量。目前,AVP-786正在进行临床试验,用于治疗焦虑不安(三期)、精神分裂症(二/三期)。而在二期临床研究中,AVP-786还包括脑损伤、冲动控制障碍、重度抑郁症、神经退行性疾病等适应症。
总之,右美沙芬/安非他酮是一种口服快速起效的NMDA受体拮抗剂,具有多种活性。该药物通过同时靶向单胺、NMDA受体和sigma-1受体来实现药理协同作用,比单独使用安非他酮治疗更快速、更有效地降低抑郁评分。右美沙芬/安非他酮具有与氯胺酮类似的药理特性,是治疗抑郁症的一种非常有前途的新药物。

参考资料
1.Stahl SM. Stahl’s Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. 4th ed. New York, NY: Cambridge University Press; 2013.
2.Stephen M. Stahl et al; Dextromethorphan/Bupropion: A Novel Oral NMDA (N-methyl-d-aspartate) Receptor Antagonist withMultimodal Activity, CNS Spectrums (2019), 24, 461–466.
3. L. Nguyen et al. / Pharmacology & Therapeutics 159 (2016) 1-22.
4.尹一淑等, 抑郁症相关发病机制研究进展. 医学综述2022年6月第28卷第12期.
5.《精神障碍诊疗规范(2020年版)》.
6.Xue-mei Qin etal; Research on the Pathological Mechanism and Drug Treatment Mechanism of Depression; Current Neuropharmacology, 2015, 13, 514-523.
7.Dextromethorphan/Quinidine AVP 923, Dextromethorphan/Cytochrome P450-2D6 Inhibitor, Quinidine/Dextromethorphan. Drugs R D 2005; 6 (3): 174-177 ADIS R&D PROFILE 1174-5886/05/0003-0174/$34.95/0.
8.Rita Khoury et al; AVP-786 as a promising treatment option for Alzheimer’s Disease including agitation.https://doi.org/10.1080/14656566.2021.1882995.
9.智慧芽新药情报库.