预约演示
更新于:2025-05-07
Analgesia
镇痛
更新于:2025-05-07
基本信息
别名 Analgesia、Analgesias、analgesia + [5] |
简介 Methods of PAIN relief that may be used with or in place of ANALGESICS. |
关联
124
项与 镇痛 相关的药物作用机制 μ opioid receptor激动剂 |
在研机构 |
原研机构 |
非在研适应症- |
最高研发阶段批准上市 |
首次获批国家/地区 中国 |
首次获批日期2024-01-30 |
2,284
项与 镇痛 相关的临床试验NCT05612399
Precision Perioperative Methadone Use in Adult Cardiac Surgical Patients to Reduce Opioid Use Adverse Effects While Improving Analgesia and Outcomes
The proposed research is an important extension of an ongoing perioperative personalized analgesia and intravenous opioid pharmacogenetic research. This research focuses on two of the most commonly used oral opioid analgesics, oxycodone, and methadone in elderly adults undergoing cardiac surgery.
开始日期2026-04-01 |
申办/合作机构 |
NCT05968261
Implementation and Measurement of a Real-time, Near-remote Method to Operationalize Ultrasound-based Regional Anesthesia/analgesia Procedural Techniques
Ultrasound-guided regional anesthesia/analgesia techniques (or simply, 'regional blocks') have gained popularity as they can reduce, and sometimes even eliminate, the need for opiate analgesics (and, consequently, their side effects), thereby improving patient safety, reducing length of hospital stay and medical costs, and improving patient satisfaction. However, a major barrier to mainstream uptake of such techniques relates to training. These techniques require the acquisition of new skills under expert guidance, which is often not possible given the daily demands placed upon anesthesiologists. As a result, many opportunities for providing regional blocks may be missed.
The purpose of this study is to implement a new real-time 'near remote' guidance method in which trainees who are to perform regional blocks can do so via tele-mentoring under expert guidance. This will be done using a novel technology whereby the ultrasound image is concurrently displayed on an iPad screen (for the block operator/trainee) as well as on the (near remotely supervising) expert mentor's smartphone. Trainees and mentors will use this method to perform various standard of care regional blocks, either in the perioperative or emergency department settings. Participants' opinions of the novel teaching and learning method will be assessed.
The purpose of this study is to implement a new real-time 'near remote' guidance method in which trainees who are to perform regional blocks can do so via tele-mentoring under expert guidance. This will be done using a novel technology whereby the ultrasound image is concurrently displayed on an iPad screen (for the block operator/trainee) as well as on the (near remotely supervising) expert mentor's smartphone. Trainees and mentors will use this method to perform various standard of care regional blocks, either in the perioperative or emergency department settings. Participants' opinions of the novel teaching and learning method will be assessed.
开始日期2026-01-01 |
NCT04336046
Ultrasound Guided Bilateral Erector Spinae Block as Analgesia for Adolescent Idiopathic Scoliosis Correction
Scoliosis is a structural, tridimensional deformity of the spine. Characterized by lateral curvature and rotation of the vertebrae with functional limitations and cosmetic problems, idiopathic scoliosis, which accounts for 75% to 80% of all scoliosis, is the most common of all types. (1, 2) Surgical treatment is an effective way to correct severe spine deformity when the deformity progressively worsens and cannot be positively corrected by brace treatment. Spinal correction surgery is one of the most invasive surgical procedures and usually results in moderate to severe levels of postoperative pain. (3) Severe pain may induce implant complications such as construct dislodgement, broken instrumentation, and implant loosening which requires additional revision procedures These conditions adversely affect postoperative outcomes.(4) In the past several years, pain has become an important indicator for evaluating indicators of outcome and quality of life after surgery. Effective analgesia after surgery could improve patients' prognosis.(5) The erector spinae block is a recently described ultrasound-guided technique in which local anesthetics is injected into a fascial plane between the tips of the thoracic transverse processes and the overlying erector spinae muscle (longissimus thoracis).(6) The available evidence indicates that erector spinae block is effective in reducing opioid requirements and improving the pain experience in a wide range of clinical settings. They are best employed as part of multimodal analgesia with other systemic analgesics
开始日期2025-12-31 |
申办/合作机构 |
100 项与 镇痛 相关的临床结果
登录后查看更多信息
100 项与 镇痛 相关的转化医学
登录后查看更多信息
0 项与 镇痛 相关的专利(医药)
登录后查看更多信息
719
项与 镇痛 相关的文献(医药)2025-04-01·Journal of Dental Sciences
A scientometric study on research trends and characteristics of burning mouth syndrome
Article
作者: Zhang, Ying ; Zhu, Qi ; Liu, Wei ; Wu, Lan
2025-02-01·Addiction Biology
Identification of ethanol analgesia quantitative trait loci and candidate genes in BXD recombinant inbred mouse lines
Article
作者: Damaj, M. Imad ; Miles, Michael F. ; Presley, Alyssa ; Rogers, Walker D.
2025-01-01·Journal of Clinical Anesthesia
Oral ketamine for acute analgesia after major spine surgery
Letter
作者: Hu, Bang-Sheng ; Han, Shuai ; Gao, Ju ; Tang, Hai-Xia
629
项与 镇痛 相关的新闻(医药)2025-05-02
·药智网
在医药行业,什么“赛道”算是“好赛道”?是创新驱动的技术突围,还是精准捕捉未被满足的临床需求?或许,真正的“好赛道”,从来都是价值与增长的双向奔赴,既能以独家优势构筑壁垒,更能在市场验证中持续盈利。在近日发布的年报中,九典制药的业绩表现再次诠释了这个道理:2024年营业收入29.3亿元,同比上升8.9%;归母净利润5.12亿元,同比上升39.1%;扣非归母净利润4.75亿元,同比上升39.7%。拉长时间线来看,这已经是九典制药连续10年营收正增长,净利润连续5年保持30%以上增长。与此同时,越来越多药企将目光投向贴膏这一“不起眼”的赛道,行业竞争正持续加剧。1盈利超5亿九典制药成立于2001年,初期十几年与多数传统药企一样,以仿制药、原辅料及植物提取物为主业。在抗感染、消化、呼吸等领域推出奥硝唑分散片、泮托拉唑钠肠溶片等药品,凭借疗效与质量积累市场份额,为后续发展奠定了基础。2017年是九典制药的关键转折:作为湖南新三板转主板首股登陆深交所创业板,上市首日股价大涨近44%;同年自主研发的洛索洛芬钠凝胶贴膏获批上市,作为国内首个化药凝胶贴膏消炎镇痛剂型,2019年销售额破亿,2022年、2023年分别达13.03亿元、15.47亿元,占营收超57%。2024年院内销量同比增25.65%,院外线下OTC市场增幅173.79%,展现出强大的市场竞争力。九典制药的药品制剂产品中,洛索洛芬钠凝胶贴膏和酮洛芬凝胶贴膏由于研发难度高,长期无直接竞品,市场占有率长期保持100%。在此背景下,九典制药营收从2017年5.35亿元增至2024年29.31亿元,净利润从6857万元增至5.12亿元,年复合增长率高达33%。其产品结构也从仿制药为主转向化药贴膏主导,毛利率由2017年51.94%提升至2021年的78.50%。除贴膏产品外,九典制药其他制剂通过多渠道营销持续保持市场竞争力,其中泮托拉唑钠肠溶片、洛索洛芬钠片、枸橼酸氢钾钠颗粒、乙酰半胱氨酸颗粒等产品,在国内公立及县级公立医院销售额排名稳居前三。九典制药主导产品销售额排名及市占率图片来源:九典制药年报作为九典制药业务板块的重要一环,原料药和药用辅料业务同样展现出强大的竞争力,全年原辅料及植物提取物销售收入5.3亿元,同比增长28.22%。原料药产品结构持续优化,新原料药客户新增近百家,血液制品辅料实现突破。国际市场上,千万级原料药出口品种增至4个,铝碳酸镁、铝镁加获拜耳等企业认可,生物疫苗注射用辅料辛酸钠、麦芽糖开启海外商业化合作。在稳固主业基础上,九典制药依托“药品制剂+原料药+药用辅料”一体化研发生产优势拓展CXO服务。2024年新增CMO委托项目46个,同步推进受托项目进度,13个受托项目完成审批并落地商业化生产,为业绩增长注入新动能。2025年一季度,九典制药延续增长态势,实现收入6.96亿元,同比增长17.79%,扣非净利润1.24亿元,同比增长16.54%。值得注意的是,公司的销售费用率已连续3年大幅下降,从2022年的52.43%,下降至38.95%,降本增效成果显著。2化药贴膏龙头从仿制药到化药贴膏的转型,九典制药用7年时间完成了从“跟随者”到“领跑者”的蜕变。当洛索洛芬钠凝胶贴膏以年销15亿的成绩成为现象级单品,其背后不仅是单一产品的成功,更是九典制药在透皮给药领域技术积累与市场洞察的集中爆发。在国内,贴膏已有上千年的历史,是中医药的重要组成部分。传统中药贴膏剂一般作用于局部镇痛抗炎领域,适应症主要包括骨关节炎、肩颈疼痛、腰痛、骨质增生、风湿病、急性挫伤、扭伤、跌打瘀痛、落枕以及肌肉劳损等。随着技术进步,现代化透皮贴剂即化药贴膏的应用范围逐渐拓展,除了镇痛消炎领域,还被用于绝经引起的中度至重度血管舒缩症状、阿尔茨海默病、注意力缺陷多动障碍、重度抑郁症、慢性疼痛的控制、恶心和呕吐的预防、预防心绞痛等领域,是除口服、注射外的第三大给药机制。数据显示,2023年我国药用贴膏剂行业市场规模约为204亿元,其中中成药贴膏市场规模为135亿元,占总市场比重达到66%;化药贴膏剂占比逐年增长,由2020年的26%提升至2023年的34%,市场前景极为广阔。与传统中药贴膏技术门槛低、资产投入小不同,化药贴膏工艺复杂且研发难度极高,尤其凝胶贴膏的制备堪称“卡脖子”技术,需攻克交联架桥、水凝胶体系稳定性、药物透皮吸收效率等核心难题。九典制药自2010年布局透皮给药领域,在突破上述技术壁垒后,成功推出洛索洛芬钠凝胶贴膏。2024年之前国内化药凝胶贴膏市场仅6款产品上市,这意味着,在化药贴膏这个市场里,只要突破了技术壁垒,便有望成为一款“重磅炸弹”。而在这仅有的6款上市产品中,九典制药独占其中2席:2023年再次拿下酮洛芬凝胶贴膏国内首仿,并在年底成功纳入医保。作为日本镇痛领域销量领先的外用制剂,该产品2022年市场规模达到16亿元,凭借替代传统贴膏剂的显著优势,正成为九典制药的第二增长极。与此同时,九典制药通过自主研发与并购引进持续丰富产品矩阵,多款在研产品推进至申报生产或临床阶段:2024年完成消炎解痛巴布膏再注册;氟比洛芬凝胶贴膏、吲哚美辛凝胶贴膏、利多卡因凝胶贴膏等多个贴膏产品处于上市申请阶段。随着后续产品的逐步上市,将进一步强化公司在该领域的优势地位,带动业绩持续增长。已进入注册程序的在研项目情况图片来源:九典制药年报3群狼环伺下的突围战尽管在化药贴膏赛道占据先发优势,九典制药面临的竞争压力正呈指数级上升。2025年1月,乐明药业洛索洛芬钠凝胶贴膏获批,成为首个打破九典制药垄断的仿制药企业,随后泰德制药、南京海纳等企业相继入局,短短一个月内,4款同类产品密集获批,竞争格局骤然生变。根据国家药监局2022年发布的《局部给药局部起效药物临床试验技术指导原则》,贴剂仿制药可选择通过PK-BE(药代动力学-生物等效性)试验或开展III期临床试验进行申报。然而在实际审批中,仅以PK-BE申报的仿制药遭遇普遍否决——2020年以来,多达13款仅完成PK-BE试验的氟比洛芬凝胶贴膏仿制药上市申请均被驳回。此次乐明药业的洛索洛芬钠贴膏仅凭借BE申报成功,意味着外用贴膏仿制药审批路径的实质性突破,无需开展耗时数年、耗资千万的III期临床试验,只需通过生物等效性试验即可达成获批条件,大幅降低了技术门槛。实际上,除已获批的5家仿制药企业外,洛索洛芬钠凝胶贴膏还有至少15家企业在走上市审批流程,以目前的过评速度,竞争企业数量很快将增至十几家。对九典制药而言,独家地位一旦失守,产品势必陷入价格战,而集采将加速这一进程。此前因无直接竞品,洛索洛芬钠凝胶贴膏集采降价幅度有限:在广东联盟、京津冀“3+N”联盟、甘肃集采中以18.19元/贴中标,降幅约25%;浙江、云南集采中标价17.37元/贴,降幅约28%。随着国家及省际联盟集采的全面推进,洛索洛芬钠凝胶贴膏价格下降已成为必然的趋势。面对围剿,九典制药选择多线突围。一方面,加速OTC渠道布局,线上线下共同发力,2024年院外线下市场销售额同比增长173.79%,线上电商收入增幅达242.27%,自营渠道增长近400%;另一方面,在研发端持续投入,深化技术护城河,通过关键辅料国产替代和新型材料研发降低成本,2024年研发投入2.61亿元,占总营收8.91%。然而,行业洗牌仍在加速。羚锐制药、奇正藏药等中药贴膏龙头正跨界布局化药领域,泰德制药等企业依托产业链一体化优势抢占价格竞争空间。未来,九典能否在技术迭代与市场争夺中保持领先,将取决于其能否持续突破透皮给药技术瓶颈,并在集采常态化下找到成本与创新的平衡点。4结语九典制药的崛起,印证医药行业的“好赛道”始于独家品种填补市场空白。从仿制药转型贴膏龙头,其凭借技术突破打开增长空间,然而当“独家”优势不再,唯有持续突破技术壁垒、平衡成本与创新,才能让“好赛道”真正成为经得起竞争考验的“长久赛道”。参考资料:1.九典制药年报,官网2.《产品矩阵日益丰富,打造经皮给药制剂领域龙头企业》,国盛医药,2024年11月25日3.《化药贴膏已经没了立项的必要?》,药通社,2025-03-05声明:本内容仅用作医药行业信息传播,为作者独立观点,不代表药智网立场。如需转载,请务必注明文章作者和来源。对本文有异议或投诉,请联系maxuelian@yaozh.com。责任编辑 | 史蒂文合作、投稿、转载开白 | 马老师 18323856316(同微信) 阅读原文,是受欢迎的文章哦
财报疫苗
2025-04-30
·抗体圈
医药行业的竞争格局瞬息万变,唯有创新者方能破局而出,御风前行。近期,恒瑞医药发布了2025年第一季度报告,营收、利润均实现了不错的涨幅,这份成绩单无疑为医药行业注入了一针强心剂,向市场彰显了其在创新研发驱动下高质量发展的蓬勃活力。图1. 恒瑞医药2021-2025年Q1营收趋势,来源:百度股市通1财报数据亮眼增长彰显韧性2025年一季度,恒瑞医药交出了一份令人瞩目的成绩单。恒瑞实现营业收入72.06亿元,同比增长20.14%;归属于上市恒瑞股东的净利润达到18.74亿元,同比大幅增长36.90%;归属于上市恒瑞股东的扣非净利润为18.63亿元,同比增长29.35%。这一连串数字增长的背后,是恒瑞医药在医药市场浪潮中稳健增长的决心与实力。图2. 恒瑞医药2025年一季度主要财务数据,来源:其一季度财报从资产情况来看,截至2025年3月31日,总资产为512.93亿元,较上年度末增长2.31%;归属于上市恒瑞股东的所有者权益为469.87亿元,较上年度末增长3.22%。然而,值得注意的是,经营活动产生的现金流量净额为5.55亿元,比去年同期的12.55亿元同比下降55.75%。对此,恒瑞医药在报告中解释称,主要原因是同期收到授权款项较多及本期研发投入增加。2创新药矩阵持续扩容四大重磅产品获批上市报告期内,恒瑞创新药布局取得突破性进展,新增6项新药及适应症获批,创下季度历史新高。心血管领域破局之作:全球首个超长效PCSK9单抗瑞卡西单抗的上市,填补了国产创新药在降脂领域的空白。该产品单次给药即可维持长效降脂效果,有望重塑心血管疾病治疗格局。相关回顾:全球首个!恒瑞医药长效PCSK9单抗获批上市自免领域双线突破:中国首个自主研发的高选择性JAK1抑制剂硫酸艾玛昔替尼片接连斩获强直性脊柱炎、类风湿关节炎、特应性皮炎三大适应症。临床数据显示,其对JAK1的选择性抑制活性高于JAK2,显著降低传统JAK抑制剂的血液学毒性风险。相关回顾:恒瑞JAK1抑制剂「艾玛昔替尼」国内获批上市镇痛领域里程碑:首个国产偏向性μ阿片受体激动剂富马酸泰吉利定注射液获批术后中重度疼痛适应症。其独特的受体偏向激活机制在保证镇痛效果的同时,将呼吸抑制等副作用发生率降低。免疫治疗新势力:抗IL-17A人源化单克隆抗体夫那奇珠单抗获批强直性脊柱炎适应症,临床研究显示其ASAS20应答率显著优于传统生物制剂。3研发管线纵深推进多领域临床研究捷报频传恒瑞一季度研发投入达15.33亿元,推动临床研究取得系列突破。01肿瘤领域HER2 ADC药物瑞康曲妥珠单抗第8次纳入突破性治疗品种,适应症为用于既往接受含铂化疗及免疫检查点抑制剂治疗失败的人表皮生长因子受体2 (HER2)表达(IHC≥1+)的复发或转移性宫颈癌。CDK4/6抑制剂达尔西利在HR阳性乳腺癌辅助治疗Ⅲ期研究中,达到主要终点。研究结果显示,达尔西利联合内分泌治疗,可显著降低患者复发风险,提高患者无侵袭性疾病生存期。02代谢疾病领域新型GLP-1/GIP双受体激动剂HRS9531在减重Ⅱ期研究中表现惊艳,8mg剂量组治疗36周平均减重22.8%,媲美司美格鲁肽高剂量组疗效。其独特的双重作用机制可同时改善胰岛素敏感性与能量代谢。03国际化临床布局卡瑞利珠单抗联合化疗一线治疗晚期肺鳞癌的5年随访数据登陆欧洲肺癌大会(ELCC),5年总生存率达27.8%,较对照组提升15.3个百分点,死亡风险下降43%,助力更多患者实现长生存。截至季末,恒瑞在研管线涵盖90余个自主创新药物,开展临床试验近400项,研发效率位居全球前列。4国际化战略升级授权交易重构价值生态恒瑞持续推进全球化战略,近期完成两笔重磅授权:将Lp(a)抑制剂HRS-5346海外权益授予默沙东,首付款2亿美元,潜在交易总额达19.7亿美元。该产品靶向心血管残余风险关键靶点,单药即可降低Lp(a)水平超80%。与默克集团就GnRH受体拮抗剂SHR7280达成大陆地区商业化合作,这是继PARP抑制剂后双方的再度携手。该口服制剂在子宫内膜异位症Ⅱ期研究中,疼痛缓解率较对照组显著提升。近三年累计完成9笔对外授权,潜在总交易额超140亿美元,创新药"出海"模式已形成稳定产出。目前14个license-out项目涵盖肿瘤、自免、代谢等多领域,验证了恒瑞创新体系的国际竞争力。5未来展望站在新的发展节点,恒瑞医药未来潜藏机遇。在First-in-class方向突破,在ADC、双抗、RNA疗法等前沿领域,已有7个全球首创品种进入临床,包括靶向Claudin18.2的ADC药物SHR-A1904,临床前数据显示其肿瘤抑制率较对照药物提升2.3倍;国际化产能布局上,苏州、成都两大生物药基地通过FDA/EU GMP认证,单抗产能突破6万升,为全球商业化奠定基础。在医药行业竞争日益激烈的背景下,恒瑞医药保持了其在国内医药行业的领先地位。凭借其在创新研发、产品质量、市场营销、品牌建设等方面的优势,不断提升核心竞争力,积极应对市场变化和挑战,让我们看到了国内老牌药企的韧性。结 语恒瑞医药2025年一季度财报不仅是一份成绩的展现,更是恒瑞未来发展潜力的有力彰显。在创新的引领下,恒瑞医药正朝着国际化、高质量发展的道路砥砺前行,我们有理由相信,在未来的征程中,恒瑞医药将继续书写辉煌篇章,为全球患者带来更多福祉,为医药行业的进步贡献不竭力量。参考资料:1. 恒瑞医药公众号2. 恒瑞医药2025年一季度报告识别微信二维码,添加抗体圈小编,符合条件者即可加入抗体圈微信群!请注明:姓名+研究方向!本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。
财报抗体药物偶联物上市批准
2025-04-29
·肿瘤界
点击蓝字 关注我们引用本文:中国临床肿瘤学会淋巴瘤专家委员会,中国临床肿瘤学会白血病专家委员会,中国临床肿瘤学会骨髓瘤专家委员会,等.多发性骨髓瘤骨病临床诊疗指南(2024年版)[J/CD].肿瘤综合治疗电子杂志,2025,11(2):85-94.1 概述多发性骨髓瘤(multiple myeloma,MM)是浆细胞异常增生并分泌单克隆免疫球蛋白及其片段(M蛋白),进而引发相关组织及器官损伤的一种血液系统恶性肿瘤[1]。多发性骨髓瘤骨病(multiple myeloma bone disease,MBD)是其进展的重要临床表现,MBD是指由MM细胞所致的骨破坏病变,临床表现为骨质疏松、高钙血症、溶骨性破坏及病理性骨折等。2014年国际骨髓瘤工作组(International Myeloma Working Group,IMWG)更新了MM的诊断标准,其中MBD的定义为骨放射学检查[X线、计算机断层扫描(computed tomography,CT)、全身低剂量CT(whole body low dose CT,WBLD CT)、磁共振成像(magnetic resonance imaging,MRI)或正电子发射断层扫描/CT(positron emission tomography/CT,PET/CT)]上可见≥ 1个穿凿样溶骨性骨破坏病灶(≥ 5 mm)[2]。这些患者发生骨相关事件(skeletal-related event,SRE)的风险高,包括病理性骨折、脊髓压迫等,需要手术或放射治疗(以下简称放疗)干预,增加了患者的疾病负担,降低了患者的生活和生存质量[3]。中华医学会血液学分会与中国抗癌协会血液肿瘤专业委员会于2011年制定了《多发性骨髓瘤骨病诊治指南(2011版)》[4],国际骨髓瘤基金会中国多发性骨髓瘤工作组外科治疗专家委员会2016年制订了《多发性骨髓瘤骨病外科治疗中国专家共识》[5],中国临床肿瘤学会指南工作委员会2021年制定了《多发性骨髓瘤骨病临床诊疗专家共识2021》[6],中国抗癌协会血液肿瘤专业委员会与中华医学会血液学分会2022年制定了《中国多发性骨髓瘤骨病诊疗指南(2022年版)》[7],有力推动了我国MBD的规范诊疗。近年来,随着MBD领域的诊疗发展,以及强调多学科协作模式和MBD的全程管理,优化了MBD的治疗。中国临床肿瘤学会淋巴瘤专家委员会、中国临床肿瘤学会白血病专家委员会、中国临床肿瘤学会骨髓瘤专家委员会、北京慢性病防治与健康教育研究会组织专家对既往共识进行了更新,升级为《多发性骨髓瘤骨病临床诊疗指南(2024年版)》,以更好地指导MBD诊疗的临床实践。2 多发性骨髓瘤骨病的诊断MBD的影像学检查方法包括X线检查、CT、MRI、PET/CT等,其中X线检查因敏感度低,骨量丢失达到30%~50%才能被检出,其已逐步被其他手段取代。目前认为WBLD CT是评估MBD的首选影像学检查,MRI是评价骨髓浸润程度和脊髓压迫的首选手段,PET/CT主要用于髓外病变的范围和骨髓微小残留病变(minimal residual disease,MRD)的评估以及对疾病预后的判断[8]。2.1 X线检查X线检查敏感度低,据统计,约20% X线检查阴性的患者,通过其他检查可发现MM活动的证据[9]。由此X线检查已经逐步被其他检查取代。专家组建议仅在其他影像学手段不可及的情况下,推荐使用X线检查作为MBD的诊断。2.2 CTCT可发现早期骨质破坏,对于溶骨性病变尤其敏感,对于脊柱、肋骨和骨盆的病灶检出率高于X线检查,费用相对较低,可及性较好,故专家组建议将WBLD CT作为MBD诊断和治疗后评估的主要手段。2.3 MRIMRI是检测MM骨髓浸润的“金标准”,对于可疑病灶是否存在肿瘤浸润有重要的鉴别价值。对于存在脊柱压缩性骨折的患者,MRI检查可以了解脊髓压迫情况。上海交通大学医学院附属瑞金医院的临床研究数据显示,弥散加权成像(diffusion weighted imaging,DWI)能有效反映骨髓血管形成和细胞增生程度,表观扩散系数的变化与缓解深度明确相关,可作为预测深度缓解的有效手段[10]。2.4 PET/CTPET/CT可有效检测MM细胞的代谢活性,对于溶骨性病灶和骨质破坏非常敏感,且易检测出髓外病灶,在整体MBD的诊断方面有重要作用。但在无骨质破坏的情形下,如仅有代谢活性增强,不足以诊断MBD。同时,作为影像学MRD评估的检测手段,残留的局部病灶对于MM患者的预后有判断价值,有临床研究推荐在骨髓瘤患者诱导治疗后或维持治疗前进行PET/CT检查。但受到高昂费用和可及性差的影响,专家组建议应当根据具体情况决定是否采用PET/CT用于MBD诊断的各类影像学检查的优点和缺点比较见表1。2.5 实验室诊断在MBD的实验室诊断方面,高特异度和敏感度的实验室指标还有待进一步的研究。MBD患者存在骨吸收亢进和骨转换率增高,国内研究者发现,β-异构化的C-端肽Ⅰ型胶原片段(β-CTx)(反映骨吸收能力)、骨钙素(反映骨转换率)可有效反映MBD患者的骨损伤程度,在广泛型骨损伤的MBD患者中,β-CTx、骨钙素含量及β-CTx与总Ⅰ型胶原氨基端延长肽TP1NP(反映骨合成能力)的比值显著增加。尤其是β-CTx对广泛型骨损伤MBD患者的诊断具有重要价值[11-12]。而国外学者研究发现,在达到缓解的患者中,治疗6个月时β-CTx水平与基线时无明显差异,而在治疗无效的患者中,治疗6个月时β-CTx水平对比基线时显著升高,提示监测β-CTx变化有助于判断患者对治疗的反应[13]。指南推荐意见:(1)MBD的诊断是活动性MM全面诊断的重要组成部分。凡是考虑诊断为活动性MM患者均应进行影像学检查。同时对于无靶器官损害的患者,MRI检查出现>1处且>5 mm的局灶性骨质破坏也是需要启动治疗的指征。(2)普通X线检查:推荐在其他检查不可及时,作为MBD的筛查;对颅骨、四肢长骨病灶敏感度好,可作为其他检查手段的补充。(3)WBLD CT检查:推荐作为诊断和评估MBD的常规检查手段,肋骨CT三维成像有助于发现肋骨病变。(4)MRI检查:推荐作为评估骨髓浸润的“金标准”,可以鉴别可疑溶骨性病灶和骨质疏松部位是否存在骨髓浸润。对于CT未检出明显骨质破坏的患者,可考虑行脊柱和骨盆MRI检查以排查符合骨髓瘤定义事件的局部病灶。MRI同时适用于颈椎、胸椎、腰椎、骨盆病变及脊髓压迫等检查。(5)PET/CT检查:推荐对于存在可疑髓外浆细胞瘤的患者进行检查。对于达到骨髓MRD阴性的患者,推荐作为影像学MRD检测。(6)不再推荐骨密度和发射型计算机断层成像(emission computed tomography,ECT)作为诊断MBD的常规检查手段。3 多发性骨髓瘤骨病预防与治疗标准化、规范化的抗MM治疗是治疗MBD的基础和最重要的部分。通过抗肿瘤治疗可以延缓MM的病理进程,避免进一步加剧骨质破坏,达到治疗骨病的作用。此外,针对MBD的预防和治疗还包括减少骨质破坏、减轻骨痛症状以及降低骨病并发症的发生率。骨靶向药物是治疗骨病、延缓SRE发生的常用药物。3.1 一般治疗除外脊椎骨骨折的急性期,一般情况下不建议患者绝对卧床,否则更易发生脱钙。鼓励患者进行适当的活动,如步行、游泳等,但应避免剧烈运动或对抗性运动。存在脊柱病变的患者应卧加有软垫的硬板床,预防脊椎骨骨折导致的脊髓压迫。3.2 骨靶向药物专家组推荐临床应用骨靶向药物的适应证包括:①所有活动性MM患者,无论在影像学检查中是否存在MM相关骨病证据,均应接受骨靶向治疗,包括双膦酸盐或地舒单抗[14]。②MM伴高钙血症:中、重度高钙血症(校正后血钙≥2.9 mmol/L)需要立即使用骨靶向药物,同时给予静脉水化,加用呋塞米等利尿药,并使用糖皮质激素。③孤立性浆细胞瘤、意义未明单克隆免疫球蛋白血症、冒烟型MM:仅在伴有骨质疏松的情况下推荐使用骨靶向药物[14-15],应用方法应参照骨质疏松指南[16]。临床用于MBD预防和治疗的骨靶向药物的适应证以及禁忌证见表2。其中第一代不含氮的双膦酸盐以氯屈膦酸为代表;第二代含氮双膦酸盐以帕米膦酸钠为代表;第三代双膦酸盐延长了侧链,药物活性进一步增强,如加入饱和羟链的伊班膦酸钠、环状结构的唑来膦酸和环庚胺衍生的因卡膦酸二钠[17],相比前两代,除减轻症状、延缓SRE获益外,还可显著降低高钙血症风险、提升骨密度、改善骨代谢,例如:因卡膦酸相比其他第三代双膦酸盐,发热、肾毒性及下颌骨坏死等不良反应发生率更低[18]。目前,尚缺乏确凿的循证医学证据支持伊班膦酸钠在预防和治疗MBD方面的有效性。3.2.1 双膦酸盐药物的选择双膦酸盐是一类焦膦酸盐分子的稳定类似物,被破骨细胞内吞后,可诱导破骨细胞凋亡,抑制溶骨[19]。多项临床试验表明,应用双膦酸盐可有效降低MM的SRE、病理性骨折的发生和缓解骨痛。双膦酸盐类药物化学结构不同,因此其临床活性和功效亦有不同。目前在MM中研究较多的双膦酸盐主要有氯屈膦酸、帕米膦酸、唑来膦酸等。选择双膦酸盐时应综合考虑不同药物的优缺点,尤其应注意双膦酸盐可能引起的肾毒性和颌骨坏死(osteonecrosis of the jaw,ONJ)。一项大型双盲、随机临床试验表明,每月静脉注射帕米膦酸钠较安慰剂可以减轻患者疼痛和骨相关并发症,并改善MM DS Ⅲ期患者和≥1处溶骨性病变患者的生活质量[20]。另一项Ⅲ期研究中,研究人员对比了唑来膦酸和帕米膦酸在乳腺癌及MM患者中的长期疗效和安全性。结果显示,唑来膦酸组和帕米膦酸组在预防≥1次SRE发生率上无显著差异(P=0.593),且至首次发生SRE的时间也相似(P=0.538),从而证实了唑来膦酸和帕米膦酸在骨病治疗方面的疗效和安全性[21]。Ⅲ期MRCIX研究比较了在抗MM治疗基础上加入唑来膦酸对比氯屈膦酸的疗效。研究结果显示,相比氯屈膦酸,唑来膦酸能明显降低SRE发生风险(P=0.0004),显著延长MM患者中位无进展生存(progression-free survival,PFS)时间(19.5个月比17.5个月,P=0.07)和中位总生存(overall survival,OS)时间(52个月比46个月,P=0.04)[22]。进一步的安全性数据显示,唑来膦酸与氯屈膦酸不良事件发生率相当。但研究显示,唑来膦酸的ONJ发生率高于氯屈膦酸(3.7%比0.5%)[23]。以上研究表明,唑来膦酸治疗MBD疗效优于氯屈膦酸,与帕米膦酸相当。鉴于唑来膦酸简易的给药程序和与降低死亡率相关联的显著效果,可能在临床选择上优于帕米膦酸。一项单中心回顾性队列研究表明,与持续双膦酸盐治疗相比,连续接受>3个月双膦酸盐治疗后转为地舒单抗治疗的患者SRE风险显著降低(HR=0.47,P=0.019)[24]。这些证据表明,从双膦酸盐转换至地舒单抗治疗可能带来临床上的益处,双膦酸盐转换治疗也是骨转移患者治疗的一种选择。另一项研究显示,双膦酸盐转换治疗可以为进展性骨转移患者带来生存获益,接受双膦酸盐转换治疗的患者OS时间显著延长(P<0.01)[25]。3.2.2 地舒单抗地舒单抗作为首个全人源化的IgG2单抗,通过特异性结合核因子κB受体活化因子配体(receptor activator of nuclear factor-κ B Ligand,RANKL),阻断其与RANK的相互作用,抑制破骨细胞的活化,减少了骨质吸收并促进了骨骼的重建。地舒单抗的适应证和禁忌证见表2。一项Ⅲ期研究评估新诊断MM患者接受地舒单抗对比唑来膦酸治疗的疗效和安全性,在推迟首次发生SRE时间上地舒单抗不劣于唑来膦酸(HR=0.98,P非劣效=0.01),地舒单抗组较唑来膦酸组可显著延长患者中位PFS时间(46.1个月比35.4个月,P=0.036)。药物安全性显示,地舒单抗组患者肾毒性发生率明显低于唑来膦酸组(10%比17%)[26]。对该研究的亚洲人群(n=196)分析显示,地舒单抗组和唑来膦酸组的SRE发生率分别为38.8%和50.5%(HR=0.77,95%CI为0.48~1.26),治疗过程中地舒单抗组的肾毒性发生率明显低于唑来膦酸组(8.8%比21.7%),而两组间ONJ和低钙血症的发生率相近[26-27]。地舒单抗在预防SRE方面的效果与唑来膦酸相当,为MM患者提供了一种具有新颖作用机制的治疗选择。相比唑来膦酸,地舒单抗不仅能显著延长患者的PFS时间,还具有给药便利性和较低的肾毒性发生率。此外,在中重度肾功能不全的患者群体中,地舒单抗的使用剂量无需调整。基于以上数据,地舒单抗被获批用于MM患者SRE的预防,《多发性骨髓瘤骨病临床诊疗专家共识2021》[6]、美国国家综合癌症网络《多发性骨髓瘤指南(2024第4版)》[28]、美国临床肿瘤学会临床实践《骨修饰剂在多发性骨髓瘤中的作用》[15]及国际骨髓瘤工作组骨工作组的建议《多发性骨髓瘤相关骨病的治疗》[14]均将地舒单抗更新为MBD的治疗推荐,对于肾功能不全的患者优先推荐使用地舒单抗。3.3 骨靶向药物在肾功能不全患者的应用骨靶向药物的剂量和在肾功能不全患者中的用法用量调整见表3。3.4 骨靶向药物的治疗疗程以及停药后管理(1)骨靶向治疗的持续时间:从MM初始治疗即开始持续使用骨靶向治疗(双膦酸盐或地舒单抗)直至满2年。2年后是否继续用药应根据临床判断而定。(2)治疗间隔:骨靶向治疗的用药频率(每月1次或每3个月1次)取决于患者的个体标准、对治疗的反应以及所使用的药物。接受唑来膦酸治疗的患者,建议1次/月治疗,至少持续12个月;若12个月后获得非常好的部分缓解(very good partial response,VGPR)或以上的疗效,可以降低给药频率为每2~3个月1次,或根据骨病严重程度适当延长给药间隔;若12个月时仍未达到VGPR,则需持续每月应用唑来膦酸直至疗效达到VGPR或以上,然后可以考虑降低给药频率或停用。停用双膦酸盐前需全面评估骨折的发生风险,包括性别、年龄、人种、体重指数、与继发性骨质疏松相关的全身疾病状态(MM以外)、每日及累积糖皮质激素剂量。接受地舒单抗治疗的MBD患者,建议每月1次,持续至给药后2年。(3)停药后的管理:接受地舒单抗治疗的患者如果随后中断治疗,应维持性每6个月应用1次地舒单抗,或应用1次双膦酸盐,以降低骨质疏松反弹的风险[29]。停止骨靶向治疗后建议密切随访,一旦随访期间疾病出现生化复发,则需重新开始骨靶向治疗以降低新的SRE风险。指南推荐意见:(1)建议使用骨靶向药物(双膦酸盐或地舒单抗)治疗MBD。地舒单抗对于SRE的预防效果与唑来膦酸相似。与唑来膦酸相比,地舒单抗的肾毒性更小,因此对于肾功能不全的患者优先推荐使用地舒单抗。(2)初诊治的MM应静脉注射双膦酸盐和/或皮下注射地舒单抗,无论骨病状态如何。(3)双膦酸盐和地舒单抗起始治疗间隔:1次/4周。(4)双膦酸盐1次/月,治疗至少持续12个月;若12个月后达VGPR或以上疗效,可考虑3个月的治疗间隔,总疗程满2年。(5)地舒单抗1次/月治疗应至少持续2年。(6)使用双膦酸盐应每月监测肌酐清除率、血钙及维生素D水平。(7)地舒单抗不需要监测肾功能,但需每月监测血钙及维生素D水平。(8)肾功能不全患者优先推荐地舒单抗。4 多发性骨髓瘤骨病多学科管理4.1 MBD多学科管理MBD治疗的目标包括:①缓解疼痛,降低血钙水平,改善生活质量;②治疗和预防SRE;③控制肿瘤进展,延长生存期。因此,需要血液科、放射科、放疗科、骨科、疼痛科等多学科综合治疗(multi-disciplinary treatment,MDT),全程参与共同管理。建议有条件的三级甲等医院成立MBD患者的MDT组。4.2 血液科血液科在MBD的全程管理中,需肩负治疗原发疾病以及治疗骨病的内科药物治疗责任。大部分情况下还需要决定发起MDT的时机及参加科室。4.3 放疗科在MBD治疗的全程管理中,协助处理MBD相关事宜,帮助决定是否予以放疗以及放疗后可能带来的不良反应及其处理方法。4.3.1 适应证放疗可用于孤立性浆细胞瘤、早期脊髓压迫症、药物无法缓解的严重骨痛,并用于预防病理性骨折。4.3.2 治疗剂量及注意事项局部放疗可有效控制疼痛,并有可能促进骨折愈合[30-32],推荐剂量为8~10 Gy/次。专家组特别提醒:对放射区域和放射技术的精心规划尤为重要,以减少对脊髓、大脑、骨髓以及邻近风险器官的毒性。应限制放射野范围以减少辐照对造血干细胞采集的影响或其对未来潜在治疗的影响。例如:对于严重症状性脊髓压迫,通常更倾向于采用中等分割剂量方案,即20~25 Gy分为8~10次疗程,而非更高剂量(如30 Gy),以减少不必要的毒性,并降低对邻近/重合器官(如脊髓)未来治疗可能带来的风险[33]。放疗不应延后至全身治疗后再开始,可与全身治疗同步进行,放疗期间需密切监测以评估和控制潜在的毒性反应[34]。4.4 骨科骨髓瘤外科治疗的目的不是根治疾病,而应以缓解症状、提高生存质量为重点,通过手术早期干预治疗潜在的或已经发生的病理性骨折、解除脊髓与神经根压迫,缓解疼痛,重建骨连续性及脊柱、骨盆等重要结构的稳定性,为患者后续的治疗创造条件。4.5 疼痛科若患者出现严重疼痛时需选择镇痛药物。镇痛药的用药剂量应作为临床治疗正式记录的一部分。这些记录可以作为疼痛治疗评估的1个半定量指标。镇痛需求的减少往往意味着治疗有效。处方类镇痛药的应用应遵照世界卫生组织的“镇痛阶梯”原则[35-42],但应尽量避免使用或谨慎使用非甾体抗炎药,原因为其有肾功能损害及胃肠道刺激等不良反应。5 多发性骨髓瘤骨病患者随访与管理在MM的治疗过程中,MBD的管理至关重要。MBD不仅影响患者的生活质量,还可能导致严重的并发症。因此,制定一个全面的管理策略,包括基线评估、治疗过程管理、监测和随访等,对于提高治疗效果和改善患者预后具有重要意义。5.1 基线评估基线评估是MM治疗中至关重要的一步,其为后续治疗提供了重要的参考信息。这一阶段的评估应包括以下内容。(1)影像学评估:全身PET/CT、WBLD CT和非增强MRI等方法,能提供MBD的详细影像学特征。这些影像学检查不仅有助于诊断,还能监测疾病的进展和治疗效果(见MBD诊断相关章节)。(2)肾功能评估:基线肾功能的评估对于后续治疗中药物剂量的调整至关重要。双膦酸盐药物的肾毒性是治疗中需要特别关注的毒副作用。(3)牙科情况评估:牙科健康状态的评估有助于预防和管理ONJ。良好的口腔卫生和定期的牙科检查是预防ONJ的基本措施。(4)维生素D水平评估:维生素D水平的检测有助于评估和预防骨靶向治疗引起的低钙血症。维生素D对于钙的吸收和骨重塑过程至关重要。5.2 治疗过程中的管理策略5.2.1 MBD的随访建议每年进行1次,或根据临床指征调整监测频率。影像学方法的选择应与诊断时保持一致(如全身PET/CT、WBLD CT和MRI等方法),以便于对比。5.2.2毒副作用的监测(1)应用双膦酸盐期间肾功能的监测:在MM的疾病进程中经常伴随着肾功能不全。双膦酸盐类药物有可能导致急性肾功能不全,其肾毒性的发生率为9%~15%。肾毒性具有剂量和时间依赖性[21,43]。双膦酸盐未经代谢通过尿液排出体外,因此可与肾小管中的钙形成不溶性沉淀物,目前认为急性肾小管坏死是肾毒性的一个常见发病机制。因而推荐每次使用双膦酸盐前以及在用药过程中动态监测尿常规及肾功能(应用唑来膦酸期间每月进行1次肌酐清除率和血清电解质检测,帕米膦酸还需每月进行1次尿白蛋白检测),用药前后保持水化状态,根据肌酐清除率调整药物剂量,且在使用过程中尽可能避免或减少使用非甾体类药物、造影剂等可能损害肾功能的药物[14]。如联合用药不可避免,应至少在双膦酸盐给药后24 h使用,以降低肾脏不良反应发生风险。因卡膦酸给药后在肾脏沉积量更少,且易被快速清除,与唑来膦酸相比,可在一定程度上降低肾毒性风险。相比唑来膦酸,地舒单抗分子量大于肾小球滤过阈值,几乎不经肾脏消除,展现出较低的肾毒性,使用时无需特别监测肾功能,也无需调整剂量,因此,在肾功能不全患者中优先推荐地舒单抗[14,28]。(2)ONJ的防治:双膦酸盐及地舒单抗均可引起ONJ,最常累及的部位为上、下颌骨。影响ONJ风险增加的因素包括牙槽外科手术、口腔局部感染、诊断时发生骨质破坏或骨质疏松。建议通过保持良好的口腔卫生、定期口腔检查(每年1次或出现症状时)和避免侵入性操作来预防ONJ的发生。日本一项对连续3年收集到的临床常用双膦酸盐颌骨坏死/骨髓炎的报道中,其中因卡膦酸仅有18例(中位时间1 095 d)、唑来膦酸290例(中位时间592 d)、帕米膦酸41例(中位时间867 d)[44],因卡膦酸较其他双膦酸盐颌骨坏死的发生率更低、中位时间更长。颌骨坏死一旦发生则不可逆,随着肿瘤患者生存期的不断延长,可选择颌骨坏死风险更小的药物。在侵入性牙科操作前后应暂停双膦酸盐及地舒单抗6个月(操作前3个月及操作后3个月),考虑到MM患者由于疾病本身以及长期抗骨髓瘤治疗导致的免疫抑制状态,建议操作前1 d至操作后3 d应用抗生素预防性抗感染治疗[45]。发生ONJ的患者应停止使用双膦酸盐/地舒单抗。大多数ONJ中位4个月(2~6个月)能够获得愈合,后续可以重新开始双膦酸盐/地舒单抗治疗[29]。患者教育对于坚持牙科卫生以及早期识别和报告不良事件至关重要。(3)低钙血症的防治:维生素D为钙吸收及正常骨重塑所必需,维生素D缺乏在MM患者中常见[46],双膦酸盐及地舒单抗的常见不良反应包括低钙血症。由此补充钙和维生素D对于预防严重的低钙血症非常重要,接受双膦酸盐及地舒单抗治疗的患者在高钙血症纠正后建议补充钙片及维生素D。专家组建议在骨靶向药物治疗期间,每月监测血清钙、维生素D、磷及镁的水平,以评估是否需要额外补充[14]。具体剂量参照健康老年人推荐的钙摄入量:51~70岁的男性1000 mg/d,>50岁女性及>70岁男性1200 mg/d,最大剂量2000 mg/d。维生素D:51~70岁600 IU/d,>70岁800 IU/d,最大剂量4000 IU/d。6 总结与展望MM的规范化治疗是MBD治疗的基石和关键所在。随着MBD的诊断完善和相关指南的推广,可以帮助血液科根据实际情况规范使用双膦酸盐和地舒单抗。目前新型三代双膦酸盐因卡膦酸二钠[47-48]及IGg4亚型全人源化抗RANKL抑制剂纳鲁索拜单抗[49]治疗MBD的研究正在进行。纳鲁索拜单抗是我国原研的全球首个全人源IgG4 RANKL抑制剂,是国家1类生物制品,其Fab段采用S228P突变改造,避免lgG4抗体的Fab臂交换,抗体更加稳定[50]。一项评价纳鲁索拜单抗治疗不可切除或手术困难的骨巨细胞瘤患者疗效和安全性的单臂、开放、多中心、Ⅰb/Ⅱ期临床研究中,纳鲁索拜单抗12周的肿瘤反应率高达93.3%,整体安全可耐受[51]。另外,纳鲁索拜单抗对比地舒单抗治疗MBD的多中心、随机对照、非劣效性研究阶段性结果公布,纳鲁索拜单抗组和地舒单抗组尿肌酐校正的尿Ⅰ型胶原交联N端肽(urinary N-terminal telopeptide of type 1 collagen corrected for urine creatinine,uNTx/uCr)较基线时均呈明显的下降趋势,并在治疗期间持续维持骨破坏抑制作用。首次给药后至第13周,纳鲁索拜单抗组uNTx/uCr较基线时降幅>65%的患者比例达87.5%,地舒单抗组患者为79.7%。纳鲁索拜单抗组与地舒单抗组患者所有等级不良事件发生率分别为47.1%和65.4%。两组患者中均有4例患者发生≥3级低钙血症,治疗期间均予钙剂和/或维生素D补充治疗。未观察到首次SRE发生,也未报告颌骨坏死病例[52]。同时MBD患者的全程管理和包括血液科、骨外科、放疗科、疼痛科等MDT团队的密切合作也同样至关重要。随着近年来对于MM骨髓微环境的深入研究,发现骨髓基质细胞可以分泌白细胞介素-6、肿瘤坏死因子-α、RANKL等因子促进破骨细胞活性[12];同时上调Dickkopf相关蛋白1(DKK1)表达,通过抑制Wnt/β-catenin通路从而影响成骨细胞分化[53]。这些研究也为寻找MBD新治疗靶点提供了思路。《多发性骨髓瘤骨病临床诊疗指南(2024年版)》编写专家委员会专家组组长:马 军 哈尔滨血液病肿瘤研究所贡铁军 哈尔滨血液病肿瘤研究所主审专家:沈志祥 上海交通大学医学院附属瑞金医院秦叔逵 南京中医药大学临床学院撰写小组组员(以姓氏拼音为序):蔡 真 浙江大学医学院附属第一医院陈文明 首都医科大学附属北京朝阳医院杜 鹃 海军军医大学附属长征医院范圣瑾 哈尔滨医科大学附属第一医院贡铁军 哈尔滨血液病肿瘤研究所侯 健 上海交通大学医学院附属仁济医院贾垂明 哈尔滨医科大学附属肿瘤医院江泽飞 解放军总医院第五医学中心金 洁 浙江大学医学院附属第一医院隗 佳 华中科技大学同济医学院附属同济医院李 剑 中国医学科学院北京协和医院李 娟 中山大学附属第一医院林 颖 温州医科大学第二附属医院刘 澎 复旦大学附属中山医院刘 耀 重庆大学附属肿瘤医院路 瑾 北京大学人民医院马 军 哈尔滨血液病肿瘤研究所牛 挺 四川大学华西医院牛晓辉 北京积水潭医院秦叔逵 南京中医药大学临床学院邱录贵 中国医学科学院北京协和医学院血液病医院沈志祥 上海交通大学医学院附属瑞金医院孙春艳 华中科技大学同济医学院附属协和医院吴德沛 苏州大学医学院附属第一医院吴远彬 广东省中医院肖浩文 浙江大学医学院附属邵逸夫医院徐 燕 中国医学科学院北京协和医学院血液病医院阎 骅 上海交通大学医学院附属瑞金医院余 莉 南昌大学第二附属医院战 榕 福建医科大学附属协和医院张 曦 陆军军医大学新桥医院张东华 华中科技大学同济医学院附属同济医院周道斌 中国医学科学院北京协和医院参考文献向上滑动查看[1] COLEMAN R E. Skeletal complications of malignancy[J]. Cancer, 1997, 80(8 Suppl):1588-1594.[2] RAJKUMAR S V, DIMOPOULOS M A, PALUMBO A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma[J]. Lancet Oncol, 2014, 15(12):e538-e548.[3] TERPOS E, BERENSON J, COOK R J, et al. Prognostic variables for survival and skeletal complications in patients with multiple myeloma osteolytic bone disease[J]. Leukemia, 2010, 24(5):1043-1049.[4] 中华医学会血液学分会.多发性骨髓瘤骨病诊治指南(2011版)[M].北京:北京大学医学出版社,2011.[5] 国际骨髓瘤基金会中国多发性骨髓瘤工作组外科治疗专家. 多发性骨髓瘤骨病外科治疗中国专家共识[J].中华骨科杂志,2016,36(4):193-199.[6] 中国临床肿瘤学会指南工作委员会.多发性骨髓瘤骨病临床诊疗专家共识(2021)[J].临床肿瘤学杂志,2022,27(1):65-72.[7] 中国抗癌协会血液肿瘤专业委员会,中华医学会血液学分会.中国多发性骨髓瘤骨病诊疗指南2022[J].中华血液学杂志,2022,43(12):979-985.[8] RAJKUMAR S V. Multiple myeloma: 2022 update on diagnosis, risk stratification, and management[J]. Am J Hematol, 2022, 97(8):1086-1107.[9] WU F, BERNARD S, FAYAD L M, et al. Updates and ongoing challenges in imaging of multiple myeloma: AJR expert panel narrative review[J]. AJR Am J Roentgenol, 2021, 217(4):775-785.[10] WU C, HUANG J, XU W B, et al. Discriminating depth of response to therapy in multiple myeloma using whole-body diffusion-weighted MRI with apparent diffusion coefficient: preliminary results from a single-center study[J]. Acad Radiol, 2018, 25(7):904-914.[11] 王广洲,王正芳,王军,等.血清骨转换标志物在骨髓瘤骨病患者中的应用价值[J].中国实验血液学杂志,2020,28(5):1618-1624.[12] 褚彬,陆敏秋,吴梦青,等.多发性骨髓瘤骨病临床特点及监测骨代谢标志物的临床意义[J].中华医学杂志,2016,96(18):1424-1429.[13] AUZINA D, ERTS R, LEJNIECE S. Prognostic value of the bone turnover markers in multiple myeloma[J]. Exp Oncol, 2017, 39(1):53-56.[14] TERPOS E, ZAMAGNI E, LENTZSCH S, et al. Treatment of multiple myeloma-related bone disease: recommendations from the Bone Working Group of the International Myeloma Working Group[J]. Lancet Oncol, 2021, 22(3):e119-e130.[15] ANDERSON K, ISMAILA N, FLYNN P J, et al. Role of bone modifying agents in multiple myeloma: American Society of Clinical Oncology Clinical Practice Guideline update[J]. J Clin Oncol, 2018, 36(8):812-818.[16] GREGSON C L, ARMSTRONG D J, BOWDEN J, et al. UK clinical guideline for the prevention and treatment of osteoporosis[J]. Arch Osteoporos, 2022, 17(1):58.[17] 中国医师协会肿瘤医师分会乳腺癌学组,中国抗癌协会国际医疗交流分会.骨改良药物用于恶性肿瘤骨转移治疗的安全性共识(2024版)[J].中华肿瘤杂志,2024,46(7):637-645.[18] D'ADDARIO G, FELIP E, ESMO Guidelines Working Group. Non-small cell lung cancer: ESMO clinical recommendations for diagnosis, treatment and follow-up[J]. Ann Oncol, 2009, 20(Suppl 4):68-70.[19] VAN BEEK E, PIETERMAN E, COHEN L, et al. Farnesyl pyrophosphate synthase is the molecular target of nitrogen containing bisphosphonates[J]. Biochem Biophys Res Commun, 1999, 264(1):108-111.[20] BERENSON J R, LICHTENSTEIN A, PORTER L, et al. Longterm pamidronate treatment of advanced multiple myeloma patients reduces skeletal events. Myeloma Aredia Study Group[J]. J Clin Oncol, 1998, 16(2):593-602.[21] ROSEN L S, GORDON D, KAMINSKI M, et al. Longterm efficacy and safety of zoledronic acid compared with pamidronate disodium in the treatment of skeletal complications in patients with advanced multiple myeloma or breast carcinoma: a randomized, double-blind, multicenter, comparative trial[J]. Cancer, 2003, 98(8):1735-1744.[22] MORGAN G J, DAVIES F E, GREGORY W M, et al. Firstline treatment with zoledronic acid as compared with clodronic acid in multiple myeloma (MRC Myeloma IX): a randomized controlled trial[J]. Lancet, 2010, 376(9757):1989-1999.[23] JACKSON G H, MORGAN G J, DAVIES F E, et al. Osteonecrosis of the jaw and renal safety in patients with newly diagnosed multiple myeloma: Medical Research Council Myeloma Ⅸ Study results[J]. Br J Haematol, 2014, 166:109-117.[24] MJELSTAD A, ZAKARIASSON G, VALACHIS A. Optimizing antiresorptive treatment in patients with bone metastases: time to initiation, switching strategies, and treatment duration[J]. Support Care Cancer, 2019, 27(10):3859-3867.[25] BAL O, OKSUZOGLU B, DOGAN M, et al. Long-term outcomes of prolonged bisphosphonates more than 2 years in bone metastatic breast cancer: risk vs benefit[J]. Ir J Med Sci, 2020, 189(3):805-810.[26] RAJE N, TERPOS E, WILLENBACHER W, et al. Denosumab versus zoledronic acid in bone disease treatment of newly diagnosed multiple myeloma: an international, double-blind, double-dummy, randomized, controlled, phase 3 study[J]. Lancet Oncol, 2018, 19:370-381.[27] HUANG S Y, YOON S S, SHIMIZU K, et al. Denosumab versus zoledronic acid in bone disease treatment of newly diagnosed multiple myeloma: an international, double blind, randomized controlled phase 3 study-Asian subgroup analysis[J]. Adv Ther, 2020, 37(7):3404-3416.[28] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology-multiple myeloma (2024 Version 4)[EB/OL]. (2024-03-08)[2024-12-12]. https:// bookcafe.yuntsg.com/ueditor/jsp/upload/file/20240319/1710826999573016338.pdf.[29] BADROS A, TERPOS E, KATODRITOU E, et al. Natural history of osteonecrosis of the jaw in patients with multiple myeloma[J]. J Clin Oncol, 2008, 26(36):5904-5909.[30] RUDZIANSKIENE M, INCIURA A, GERBUTAVICIUS R, et al. Single vs multiple fraction regimens for palliative radiotherapy treatment of multiple myeloma: a prospective randomized study[J]. Strahlenther Onkol, 2017, 193(9):742-749.[31] LEE J W, LEE J E. Local radiotherapy for palliation in multiple myeloma patients with symptomatic bone lesions[J]. Radiat Oncol J, 2016, 34(1):59-63.[32] MATUSCHEK C, OCHTROP T A, BÖLKE E, et al. Effects of radiotherapy in the treatment of multiple myeloma: a retrospective analysis of a Single Institution[J]. Radiat Oncol, 2015, 10:71.[33] ELHAMMALI A, AMINI B, LUDMIR E B, et al. New paradigm for radiation in multiple myeloma: lower yet effective dose to avoid radiation toxicity[J]. Haematologica, 2020, 105:e355-e357 .[34] GUERINI A E, TUCCI A, ALONGI F, et al. RR Myelo POINT: a retrospective single-center study assessing the role of radiotherapy in the management of multiple myeloma and possible interactions with concurrent systemic treatment[J]. Cancers (Basel), 2022, 14(9):2273.[35] ISSACK P S, BARKER J, BAKER M, et al. Surgical management of metastatic disease of the proximal part of the femur[J]. J Bone Joint Surg Am, 2014, 96(24):2091-2098.[36] KYRIAKOU C, MOLLOY S, VRIONIS F, et al. The role of cement augmentation with percutaneous vertebroplasty and balloon kyphoplasty for the treatment of vertebral compression fractures in multiple myeloma: a consensus statement from the International Myeloma Working Group (IMWG)[J]. Blood Cancer J, 2019, 9(3):27.[37] MUSTO P, PETRUCCI M T, BRINGHEN S, et al. A multicenter, randomized clinical trial comparing zoledronic acid versus observation in patients with asymptomatic myeloma[J]. Cancer, 2008, 113(7):1588-1595.[38] PATCHELL R A, TIBBS P A, REGINE W F, et al. Direct decompressive surgical resection in the treatment of spinal cord compression caused by metastatic cancer: a randomised trial[J]. Lancet, 2025, 366(9486):643-648.[39] DIMOPOULOS M A, KASTRITIS E, ANAGNOSTOPOULOS A, et al. Osteonecrosis of the jaw in patients with multiple myeloma treated with bisphosphonates: evidence of increased risk after treatment with zoledronic acid[J]. Haematologica, 2006, 91(7):968-971.[40] RAJE N, TERPOS E, JANDIAL D D. Response to comment-osteonecrosis of the jaw in myeloma patients receiving denosumab or zoledronic acid[J]. Dent J (Basel), 2019, 7(2):54.[41] ENNEKING W F, DUNHAM W, GEBHARDT M C, et al. A system for the functional evaluation of reconstructive procedures after surgical treatment of tumors of the musculo skeletal system[J]. Clin Orthop Relat Res, 1993(286):241-246.[42] World Health Organization. Cancer pain relief: with a guide to opioid availability[M]. 2nd ed. Geneva, Switzerland: World Health Organization, 1996.[43] WEIDE R, KOPPLER H, ANTRAS L, et al. Renal toxicity in patients with multiple myeloma receiving zoledronic acid vs ibandronate: a retrospective medical records review[J]. J Cancer Res Ther, 2010, 6:31-35.[44] PMDA. Pharmaceuticals and Medical Devices Safety Information No. 272[EB/OL]. (2010-09)[2024-12-12]. https://www.pmda.go.jp/files/000153394.pdf.[45] MONTEFUSCO V, GAY F, SPINA F, et al. Antibiotic prophylaxis before dental procedures may reduce the incidence of osteonecrosis of the jaw in patients with multiple myeloma treated with bisphosphonates[J]. Leuk Lymphoma, 2008, 49(11):2156-2162.[46] BADROS A, GOLOUBEVA O, TERPOS E, et al . Prevalenceand significance of vitamin D deficiency in multiple myeloma patients[J]. Br J Haematol, 2008, 142(3):492-494.[47] OCHIAI N, YAMADA N, UCHIDA R, et al. Nitrogen-containing bisphosphonate incadronate augments the inhibitory effect of farnesyl transferase inhibitor tipifarnib on the growth of fresh and cloned myeloma cells in vitro[J]. Leuk Lymphoma, 2005, 46(11):1619-1625.[48] OCHIAI N, YAMADA N, UCHIDA R, et al. Combination therapy with thalidomide, incadronate, and dexamethasone for relapsed or refractory multiple myeloma[J]. Int J Hematol, 2005, 82(3):243-247.[49] AdisInsight. A multicenter, randomized, controlled, noninferiority study of narlumosbart compared with denosumab in the treatment of bone disease in patients with multiple myeloma[EB/OL].(2024-03-20)[2024-12-12].https://adisinsight.springer.com/trials/700372020.[50] RISPENS T, HUIJBERS M G. The unique properties of IgG4 and its roles in health and disease[J]. Nat Rev Immunol, 2023, 23(11):763-778.[51] DHILLON S. Narlumosbart: first approval[J]. Drugs, 2024, 84(1):105-109.[52] HUANG H, LI F, XU Y, CHEN W, et al. CLO25-072: a multicenter, randomized, controlled, non-inferiority study of narlumosbart compared with denosumab in the treatment of bone disease in patients with multiple myeloma. J Natl Compr Canc Netw[J]. 2025, 28, 23(3.5):CLO25-072.[53] POP V, PARVU A, CRACIUN A, et al. Modern markers for evaluating bone disease in multiple myeloma (Review)[J]. Exp Ther Med, 2021, 22(5):1329.推荐阅读● 《多发性骨髓瘤骨病临床诊疗指南》盛大发布● 《多发性骨髓瘤骨病临床诊疗指南》制定项目启动会成功召开声明:本文由“肿瘤界”整理与汇编,欢迎分享转载,如需使用本文内容,请务必注明出处。编辑:lagertha审核:南星
放射疗法临床研究
分析
对领域进行一次全面的分析。
登录
或
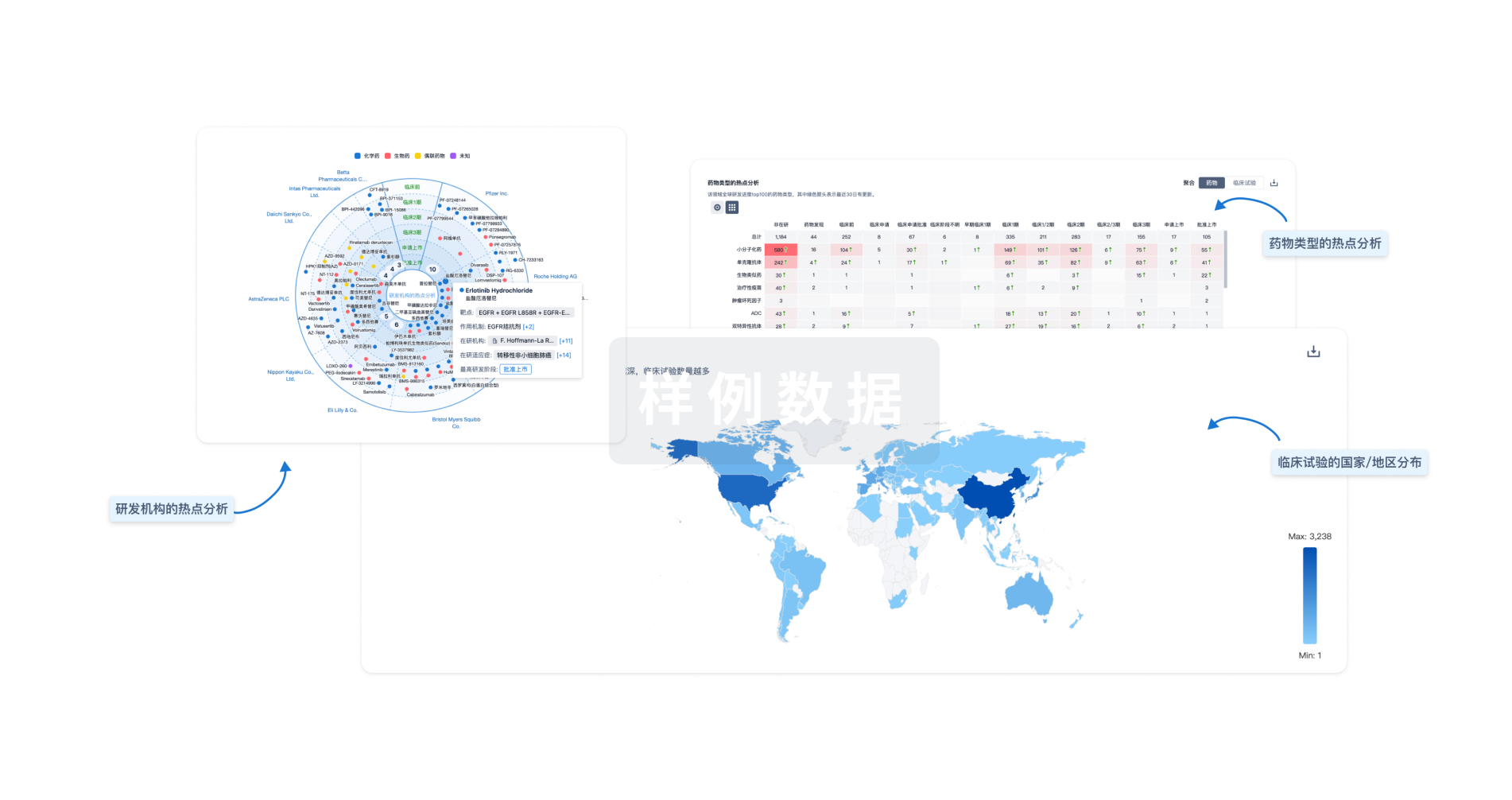
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用





