预约演示
更新于:2025-05-07
Celestial Pharmaceuticals (Shenzhen) Co. Ltd.
注销
| 深圳天济药业有限公司|私营公司|2000|中国广东省注销
| 深圳天济药业有限公司|私营公司|2000|中国广东省更新于:2025-05-07
概览
标签
遗传病与畸形
免疫系统疾病
皮肤和肌肉骨骼疾病
小分子化药
疾病领域得分
一眼洞穿机构专注的疾病领域
暂无数据
技术平台
公司药物应用最多的技术
暂无数据
靶点
公司最常开发的靶点
暂无数据
| 疾病领域 | 数量 |
|---|---|
| 免疫系统疾病 | 1 |
| 排名前五的药物类型 | 数量 |
|---|---|
| 小分子化药 | 1 |
| 排名前五的靶点 | 数量 |
|---|---|
| AHR(芳香烃受体) | 1 |
关联
1
项与 深圳天济药业有限公司 相关的药物靶点 |
作用机制 AHR激动剂 |
在研机构 |
原研机构 |
非在研适应症 |
最高研发阶段批准上市 |
首次获批国家/地区 中国 |
首次获批日期2019-05-29 |
5
项与 深圳天济药业有限公司 相关的临床试验CTR20220775
一项随机、双盲、多中心、安慰剂对照的评价本维莫德乳膏治疗轻、中度特应性皮炎的有效性和安全性的Ⅲ期临床试验
评价本维莫德乳膏治疗轻中度特应性皮炎的有效性和安全性
开始日期2022-11-02 |
申办/合作机构  广东中昊药业有限公司 广东中昊药业有限公司 [+2] |
CTR20220771
本维莫德乳膏治疗轻中度寻常型银屑病有效性与安全性:再次治疗、多中心、随机、双盲、安慰剂对照临床研究
评价本维维莫德乳膏用于轻中度寻常型银屑病长期(间歇)治疗的有效性和安全性
开始日期2022-10-17 |
申办/合作机构  广东中昊药业有限公司 广东中昊药业有限公司 [+2] |
CTR20181616
苯烯莫德乳膏在特应性皮炎患者中的全身暴露、初步疗效/安全性和药代动力学临床研究
评估苯烯莫德乳膏用于特应性皮炎患者的全身暴露情况、安全性、药代动力学以及初步有效性,以支持后续临床试验
开始日期2019-07-24 |
申办/合作机构  广东中昊药业有限公司 广东中昊药业有限公司 [+2] |
100 项与 深圳天济药业有限公司 相关的临床结果
登录后查看更多信息
0 项与 深圳天济药业有限公司 相关的专利(医药)
登录后查看更多信息
3
项与 深圳天济药业有限公司 相关的新闻(医药)2024-01-08
The Aryl hydrocarbon receptor (AHR) is a protein found in the human body that plays a crucial role in various physiological processes. It acts as a transcription factor, meaning it regulates the expression of genes involved in metabolism, immune response, and cellular differentiation. AHR is primarily known for its involvement in the detoxification of xenobiotics, such as environmental pollutants and drugs. Additionally, it plays a role in the regulation of inflammation, cell growth, and development. AHR's diverse functions make it an important target for pharmaceutical research, as modulating its activity could have significant implications for various diseases and drug development.
AHR, as a sensor for cells to perceive the external environment, is highly expressed in barrier cells and some immune cells. The AHR signaling pathway has also been proven to be a key pathway in the regulation of the immune system. AHR agonists have shown effects in some representative models of autoimmune diseases, including systemic lupus erythematosus, Behcet’s syndrome, multiple sclerosis, and inflammatory bowel disease.
At the same time, due to the diversity of AHR agonists and the different effects produced by different agonists, there are more possibilities for the design of drugs that target the activation of the AHR signaling pathway.
The analysis of the target AHR reveals that Roivant Sciences Ltd., Guangdong Zhiguang Biotechnology Co. Ltd., and Shenzhen Tianji Pharmaceutical Co Ltd. are the companies growing fastest in this field. These companies have drugs in various stages of development, indicating their strong R&D progress. The approved drugs under the target AHR are indicated for various conditions such as psoriasis, dermatitis, inflammatory bowel diseases, neoplasms, and more. This suggests a wide range of potential applications for drugs targeting AHR. The drug types progressing most rapidly are small molecule drugs and chemical drugs. China has shown progress in the development of drugs targeting AHR, along with other countries such as the United States, Canada, European Union, and Germany. Overall, the target AHR presents a competitive landscape with potential for future development in various indications and drug types.
How do they work?From a biomedical perspective, AHR agonists refer to a class of compounds or substances that activate the aryl hydrocarbon receptor (AHR) in the body. The AHR is a protein that acts as a transcription factor, meaning it regulates the expression of certain genes. AHR agonists bind to the AHR and trigger a series of cellular responses.
The AHR is primarily known for its role in mediating the toxic effects of environmental pollutants, such as dioxins and polycyclic aromatic hydrocarbons. However, recent research has uncovered that AHR also plays important physiological roles in various biological processes, including immune regulation, inflammation, and metabolism.
By activating the AHR, agonists can modulate the expression of genes involved in these processes. This can have therapeutic implications, as AHR agonists have been investigated for their potential in treating various diseases, such as autoimmune disorders, cancer, and metabolic disorders. Additionally, AHR agonists have been studied for their ability to enhance the immune response against certain pathogens.
It is worth noting that the development and use of AHR agonists as therapeutic agents are still in the early stages, and further research is needed to fully understand their mechanisms of action and potential clinical applications.
List of AHR AgonistsThe currently marketed AHR agonists include:
BenvitimodAT-177AT-193PhortressDMVT-506EXL02GDU-952ITE (AhR Pharmaceuticals)RLV-102For more information, please click on the image below.
What are AHR agonists used for?AHR agonists are used for various diseases, such as autoimmune disorders, cancer, and metabolic disorders. For more information, please click on the image below to log in and search.
How to obtain the latest development progress of AHR agonists?In the Synapse database, you can keep abreast of the latest research and development advances of AHR agonists anywhere and anytime, daily or weekly, through the "Set Alert" function. Click on the image below to embark on a brand new journey of drug discovery!
2023-09-07
The Aryl Hydrocarbon Receptor (AHR) is a transcriptional regulatory factor in cells that can bind to ligands. Normally, AHR exists in the cytoplasm, forming a complex with various companion proteins. However, upon binding with a ligand, AHR enters into the cell nucleus through the nuclear pore and forms a dimer with the Aryl Hydrocarbon Receptor Nuclear Translocator (ARNT). This formed dimer can bind with the Xenobiotic response element (XRE) in DNA, promoting the expression of downstream genes. In the nucleus, AHR can also bind with other transcription factors, thereby affecting the expression of genes regulated by the bound transcription factors.
Among the proteins regulated by the AHR signaling pathway, the cytochrome P450 superfamily is the most thoroughly researched. The activation of AHR can directly trigger the expression of proteins like CYP1A1, CYP1A2, and these enzymes play a crucial role in the metabolism of aromatic compounds: they are responsible not only for the metabolism of exogenous toxic substances but also impact the biotransformation of various drugs.
AHR acts as a sensor for cells to perceive the external environment, with high expression in barrier cells and certain immune cells. The AHR signaling pathway has also been proven to be a key signaling pathway in the regulation of the immune system. AHR agonists have shown effects in some representative models of autoimmune diseases (including systemic lupus erythematosus, Behcet's syndrome, multiple sclerosis, inflammatory bowel disease, etc.).
AHR Competitive LandscapeAccording to the data provided by Patsnap Synapse-Global Drug Intelligence Database: the following figure shows that as of 4 Sep 2023, there are a total of 19 AHR drugs worldwide, from 28 organizations, covering 22 indications, and conducting 49 clinical trials.
👇Please click on the picture link below for free registration or login directly if you have freemium accounts, you can browse the latest research progress on drugs , indications, organizations, clinical trials, clinical results, and drug patents related to this target.
The analysis of target AHR reveals a competitive landscape with multiple companies actively involved in the development of drugs targeting AHR. Roivant Sciences Ltd., Guangdong Zhiguang Biotechnology Co. Ltd., and Shenzhen Tianji Pharmaceutical Co Ltd. are among the fastest-growing companies in this field.
The indications for AHR-related drugs cover a wide range of diseases, including psoriasis, dermatitis, inflammatory bowel diseases, neoplasms, and more. Small molecule drugs and chemical drugs are the most rapidly progressing drug types, indicating intense competition in the development of innovative drugs.
China has shown progress in the development of AHR-related drugs, alongside the United States, which remains the leading country in this field. Overall, the target AHR presents a promising area for pharmaceutical development with diverse indications and active research and development efforts worldwide.
Approved AHR agonists for market launch:BenvitimodBenvitimod is a small molecule drug developed by Guangdong Zhonghao Pharmaceutical Co. Ltd. It is primarily used for the treatment of immune system diseases, congenital disorders, and skin and musculoskeletal diseases. The drug targets the AHR, which plays a crucial role in regulating immune responses and inflammation.
👇Please click on the image below to directly access the latest data (R&D Status | Core Patent | Clinical Trial | Approval status in Global countries) of this drug.
The active indications for Benvitimod include plaque psoriasis, psoriasis, dermatitis, and atopic dermatitis. These conditions are characterized by chronic inflammation and abnormal immune responses, leading to symptoms such as redness, itching, and scaling of the skin. By targeting the AHR, Benvitimod aims to modulate the immune system and reduce inflammation, providing relief to patients suffering from these conditions.
Benvitimod has received approval for use in both global and Chinese markets. The drug obtained its first approval in China in May 2019, making it available to patients in the country. The approval process for Benvitimod involved special review projects and priority review, indicating the potential significance and urgency of the drug in addressing the unmet medical needs of patients with immune system diseases and skin disorders.
As a small molecule drug, Benvitimod offers several advantages in terms of formulation, administration, and potential for oral delivery. Small molecule drugs are typically easier to manufacture and have a well-established regulatory pathway for approval. This may contribute to the drug's successful development and approval in both global and Chinese markets.
AHR agonists entering into phase I clinical trials:AT-177AT-177 is a small molecule drug that is being developed by Azora Therapeutics, Inc. It is designed to target the AHR and is intended for the treatment of digestive system disorders. The drug is currently in Phase 1 of clinical development, which is the earliest stage of testing in humans.
👇Please click on the image below to directly access the latest data (R&D Status | Core Patent | Clinical Trial | Approval status in Global countries) of this drug.
The therapeutic areas that AT-177 is focused on are digestive system disorders, specifically colitis and ulcerative colitis. Colitis refers to inflammation of the colon, while ulcerative colitis is a chronic inflammatory bowel disease that affects the colon and rectum. These conditions can cause symptoms such as abdominal pain, diarrhea, and rectal bleeding.
Being in Phase 1 of clinical development means that AT-177 is still in the early stages of testing in humans. Phase 1 trials are typically conducted with a small number of healthy volunteers or patients to evaluate the safety, dosage, and potential side effects of the drug. These trials are important for determining the appropriate dosage and identifying any potential risks or adverse reactions.
In summary, AT-177 is a small molecule drug being developed by Azora Therapeutics, Inc. for the treatment of digestive system disorders, specifically colitis and ulcerative colitis. It is currently in Phase 1 of clinical development, and its target is the AHR. Further research and clinical trials will be necessary to assess the drug's potential effectiveness and safety.
2021-03-20
近日,2020年的GDP业绩公布,广东省以11万亿元继续排名第一,和“十三五”初2015年的排名一样。江苏省以10亿元屈居第二。然而,广东的药品研发并没有如它的GDP那样亮眼。
若以新药品注册管理办法实施后获批的产品作为评判研发能力的标准,2017年以后,来自广东化学药获批的1类新药仅有3个,若按新注册分类,则只有1个获批。获得批文的三家广东企业,都不是进入2019年度中国医药工业百强的企业。宜昌东阳光2020年获批了一个1类新药磷酸依米他韦胶囊,上市许可持有人地址属于湖北省,该批文暂未统计在广东省的批文范围内。
数据来源:咸达药海数据库
广东的医药百强如今在做些什么?
根据2019年度中国医药工业百强榜的数据,广东共有5家企业进入百强榜,分别是广州医药、联邦制药、东阳光药、丽珠医药与信立泰。这五家近年以新注册分类获批的化学药,基本上都是仿制药。丽珠的注射用艾普拉唑钠以旧2类在2017年获批,是广东头部制药企业为数不多的改良创新药获批。
数据来源:咸达药海数据库
如果不以获批情况“论英雄”,广东的1类化学药新药的申报情况是如何呢?或许我们能从中看出端倪。
首先,创新类的药品获批较少,直接原因是申报较少。
以广州医药集团为例,广药仅申报了注射用头孢嗪脒钠一个产品,2017年获批临床,截至2020年,该药在CDE中显示的研发进度是,启动注射用头孢嗪脒钠单次给药安全性、耐受性及药动学研究的临床研究。
其次,创新药的研发风险比较大也是不能回避的问题。
以东阳光为例,作为广东省1类化学药申报最多的企业,目前仅有一个治疗丙肝的药物依米他韦上市。根据研究进度,下一步有可能上市的产品是处于临床Ⅲ期的丙肝类药物伏拉瑞韦和焦谷氨酸荣格列净。其余药物从进度来看,还要至少等3年才能看到是否能上市。
另外值得关注的是,一些2017年没有启动的临床批件,2018年启动了临床Ⅰ期,没有进一步进展的,都很有可能是不会继续的项目。
按这样的标准评估,东阳光可能已经砍掉9个新药项目。
若以一个项目临床前投入成本2500万元,Ⅰ期临床投入成本3500万元估算,6个项目进入Ⅰ期,3个临床前。
预计东阳光在研发项目的投入就将近3亿元,此数据还未包括新药研发五年的配套的原料药、制剂和临床的人力资源的投入。
东阳光化学药在研产品线
类型
项目名称
适应证
状态
抗感染
依米他韦
丙肝
2020年上市
伏拉瑞韦
丙肝
Ⅲ期
莫非赛定
乙肝
Ⅱa期
HEC110114
丙肝
Ⅰb/Ⅱa期
HEC84048/康达瑞韦
丙肝
Ⅰ期(2018年)
HEC74647
丙肝
Ⅰb期
盐酸哌博赛定
乙肝
临床批件(2020年)
NS5B聚合酶抑制剂,
丙肝
临床批件(2017年)
抗肿瘤
宁格替尼/ CT053
肺癌/白血病/肾癌/肝癌
Ⅰb期
莱洛替尼
食管鳞癌/胰腺癌
食管鳞癌Ⅲ期、胰腺癌Ⅰb期
英利替尼
乳腺癌
Ⅰ期(2016年)
克立福替尼
复发/难治急性髓系白血病
Ⅰ期(2018年)
CT365-Na/HEC68498
实体瘤
Ⅰ期(2018年)
HEC89736PTSA·0.5H2O
复发难治B细胞血液肿瘤
Ⅰ期
CT413
实体瘤
临床前(2015年)
代谢疾病
焦谷氨酸荣格列净
2型糖尿病
Ⅲb期
HEC96719
非酒精性脂肪性肝炎
Ⅰ期
HEC53856
肾性贫血
Ⅰ期
HEC73077
糖尿病肾脏疾病
临床批件(2021年)
HEC88473 注射液(GLP-1/FGF2121双功能分子)
糖尿病
临床批件(2021年)
其它
伊非尼酮
特发性肺纤维化
Ⅱ期
HEC30654AcOH
阿尔茨海默病
Ⅰ期(2018年)
HEC122505MsOH
帕金森病
Ⅰ期
利他匹仑
支气管哮喘
Ⅰ期(2018年)
HEC83518
失眠症
Ⅰ期
HEC113995
抑郁症
Ⅰ期
HEC81885对甲苯磺酸盐胶囊
未详
临床批件(2018年)
HEC116094HCl·3H2O
甲流
临床批件(2021年)
数据来源:咸达药海数据库
2021年失败的案例还有百奥泰。
2021年2月,百奥泰公告终止 BAT8001 (即注射用重组人源化抗 HER2 单克隆抗体-美登素偶联物,以下简称“BAT8001”) 临床试验。
2021年3月,百奥泰发布公告,称其研发的 BAT8003 (即注射用重组人源化抗 Trop2 单克隆抗体-美登素偶联物,以下简称“BAT8003”) 和 BAT1306(即重组人源化抗 PD-1 单克隆抗体注射液,以下简称“BAT1306”) 处于临床研究阶段。
经百奥泰审慎考量该药物的后续开发风险,决定终止该项目的临床试验。
BAT8001针对HER2阳性乳腺癌的III期临床研究是一项国内多中心、随机、开放、阳性对照、优效性的Ⅲ期临床研究。
截至2020年百奥泰该项目研发投入累计2.26亿元。
BAT8003是百奥泰自主开发的一种创新药物,是一种靶向Trop2的ADC药物,由糖基化修饰的重组人源化抗Trop2单克隆抗体通过定点偶联技术与Batansine进行共价连接而成。
截至2020年12月31日,BAT8003项目研发投入累计6156.5万元。
BAT1306是公司开发的针对免疫抑制检查点PD-1的单克隆抗体,单药适应证为EBV相关性胃癌,目前已开展BAT1306联合XELOX一线治疗EBV相关胃癌临床试验及BAT8001联合BAT1306二线治疗HER2阳性晚期实体瘤的临床试验。
截至2020年12月31日,BAT1306项目研发投入累计5197.45万元。
第三,新药研发周期较长,不确定性高。
新药的研发周期较长,按照目前国内的法规要求,临床前的研究信息只能从文献和会议报道获取。
新药获得临床批件后,理想状态下,I期和Ⅱ期基本都需要1到2年,Ⅲ期需要2-3年。
例如中山康方的生物制品AK101注射剂2017年9月获批临床,但是2020年还没能正式启动Ⅲ期临床研究。
中山康方AK101注射剂临床时间表
序号
登记号
试验分期
药物名称
试验通俗题目
1
CTR20201627
Ib期
AK101注射液
AK101治疗中重度活动性溃疡性结肠炎
2
CTR20201440
Ⅱ期
AK101注射液
AK101注射液(靶向IL-12/23p40单抗)治疗中、重度斑块型银屑病
3
CTR20190534
Ⅱb期
AK101注射液
AK101注射液治疗中、重度斑块型银屑病Ⅱb期临床试验
4
CTR20171655
I/Ⅱ期
AK101注射液
AK101注射液中重度斑块银屑病患者I/Ⅱ期临床研究
数据来源:CDE
化学药新注册分类发布到2021年3月的时间太短,不足以支持产品完成临床Ⅰ期、Ⅱ期到Ⅲ期整个完整的临床研究。
除了符合附条件上市的标准完成Ⅱ期临床即可申报上市的新药,其余新药都要完成临床研究Ⅲ期才能申报。
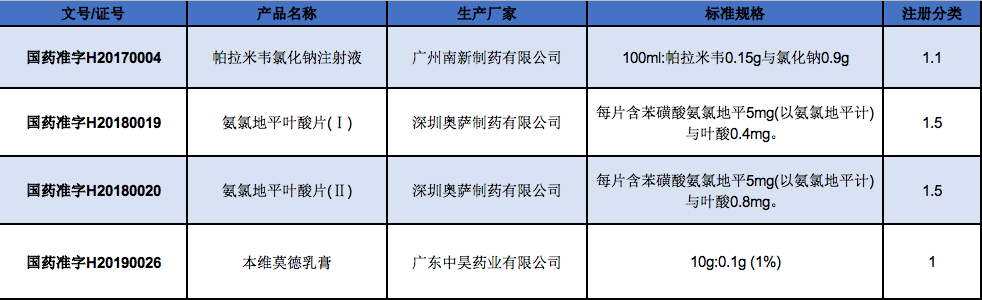
化学药新注册分类发布后,广东共申报了五个1类新药的上市申请,其中上文提及的苯烯莫德乳膏和磷酸依米他韦胶囊已获批上市。
派安普利单抗注射液是广东企业第一个也是唯一一个申报上市的PD-1注射液,申报上市时间为2020年。
相较于2018年君实生物PD-1特瑞普利单抗注射液获得国家药监局有条件批准上市,成为了首个获批上市的国产PD-1产品,整整慢了2年。
广东一个省申报1类新药上市的产品数,比不上恒瑞一家申报的数量。
受理号
药品名称
企业名称
CXSS2000022
派安普利单抗注射液
中山康方生物医药有限公司;正大天晴康方(上海)生物医药科技有限公司
CXHS2000038
奥瑞巴替尼片
广州顺健生物医药科技有限公司;上海宣泰海门药业有限公司
CXHS1900032
西格列他钠片
成都微芯药业有限公司;深圳微芯生物科技股份有限公司
CXHS1600008
苯烯莫德乳膏
广东中昊药业有限公司;北京文丰天济医药科技有限公司;深圳天济药业有限公司
CXHS1900030
磷酸依米他韦胶囊
宜昌东阳光长江药业股份有限公司;东莞东阳光太景医药研发有限责任公司;广东东阳光药业有限公司
数据来源:咸达药海数据库
广东的研发为啥迟迟不出成果?
广东省是国内药品销售市场规模最大的省,历来都是各个药企营销必定布局的省份。
但是近年来,广东的药品研发所展示的成绩单远远比不上江苏。
沪深股市中,化学制药的市值排名(由高到低)中,2021年3月16日雪球数据展示,江苏恒瑞以4737亿排名第一,广东省的信立泰和丽珠集团分别以377亿和335亿分别排名第7和第10。
生物制品领域,广东没有一家上市企业的市值能挤进前10。
港股康方生物380亿市值有挤进前10的潜力。
广东省之所以拼不过江苏省,可能原因如下:
首先,广东省只是一个省在战斗,江苏省和上海、浙江等省份紧密合作,已经形成产业协同效应。浙江省的原料药出口经过多年的积累,个别原料药产品已经是在全球具备成本优势。
广东省的企业大部分是国内流通起家,医药流通改革前靠着政策红利已经活得很滋润了,并没有积极布局原料药。广东省附近的省份如福建也没有像浙江省发展原料药进出口的生意,整个珠三角并没有建立良好的原料药基础。原料药的困境同样也体现在CRO机构,广东的CRO数量也没有长三角的多。
其次,广东企业更喜欢“取巧”。
集中带量采购后,成本管理具备竞争优势的原料制剂一体化企业更能够获得市场。没有原料优势的广东企业在竞争中更多是取巧胜出,例如第四次集采中花园药业的招标价格较高,赢得更高的市场规模引起行业热议。这其实就是广东药品企业的文化——政策机会型企业,政策导向在哪就往哪布局,更偏好读懂规则后利用规则获得更高的利润。这意味着哪类项目短期收益回报越快,广东企业就更愿意投入,重资产回报慢的项目往往在广东不受青睐。
第三,政府的投入。
广州和深圳这两年终于启动生物医药的抢人抢项目的战争。但是生物制品越到研发后期越难变更生产产地,也就是说广东省已经错过了PD-1、CAR-T最佳的发展阶段,百济神州虽然在广州有生产基地,但并不是其总部,研发核心也不在广州。这意味着未来三年的行业的生物制品的亮点业绩基本与广东无关。ADC、双抗、核酸药物或许还有争夺的机会,其中中山康方可能在双抗领域有所突破。
第四,人才的缺乏。
广东药品相关的研发高校并不多,实力最强的可能就是中山大学。中国药科大学每年毕业的学生通常会优先选择长三角,流到珠三角的人才并不多。广东最近的高校实力较强的中南大学(湘雅医学院)和湖北武汉两大领域也没有紧密的合作和人力的引流。
高技术型人才方面,广东研发人员的薪酬和长三角对比并没有优势,这主要是广东的现有的药企的营业收入水平一般,而且大部分广东的老板非常讲究年度利润业绩,根据自己的利润体量去测算研发团队的薪酬。
此外,广东的老板大多数不是研发出身而是市场营销出身,往往用营销市场的管理方法去管理研发团队,营销团队往往讲究的狼群效应,更愿意奖励头狼,但是研发更讲究的是合作,每一个环节都要达标,必须要和谐共赢的氛围,老板如果没有把关键核心环节的关键人员都照顾好,很难出成果。
因此,广东可能会出成果的企业只能期待是有技术并且有市场触觉的大牛回来创业。
抗体免疫疗法抗体药物偶联物创新药
100 项与 深圳天济药业有限公司 相关的药物交易
登录后查看更多信息
100 项与 深圳天济药业有限公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2026年02月07日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
临床3期
1
登录后查看更多信息
药物交易
使用我们的药物交易数据加速您的研究。
登录
或

转化医学
使用我们的转化医学数据加速您的研究。
登录
或

营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或

科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或

投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或

融资
发掘融资趋势以验证和推进您的投资机会。
登录
或

生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用