罗氏临床试验I期口服环肽KRASG12D抑制剂解读
近日,TOP期刊JACS更新了一篇Article,文章回顾了罗氏公司的子公司日本Chugai从筛出的hit优化到KRAS临床抑制剂Luna-18的研发过程。Luna-18是一种靶向细胞内蛋白的环肽,在未使用特殊配方的情况下,口服生物利用度依然达到(21-47%),目前处于临床一期,招募了195名患者,预计2025年3月31日结束一期。适应症为局部晚期或转移性实体瘤。
如图1,为罗氏公司今年四月份更新的部分肿瘤临床管线,箭头标记的即为LUNA18项目,临床注册为RAS抑制剂,于2021年8月进行实体肿瘤(联合治疗、单药治疗、转移性疾病、晚期疾病、复发性疾病)(PO,胶囊)的I期临床试验(NCT05012618)。黄色部分均为在全球开展的临床项目,蓝色字体为罗氏授权在日本开发或销售的项目,其中就有一直比较火热的KRAS G12C和SHP2管线。

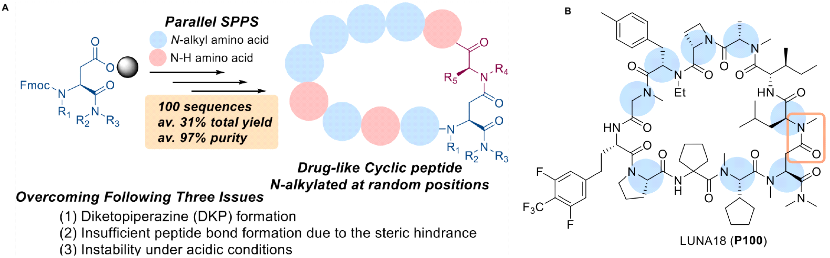
其实在2022年8月份,Chugai公司便在JMC杂志报道过一类广泛适用的合成方法来合成富含N -烷基的类药物环肽,N-烷基化的目的在于减少氢键供体、改善吸收以满足口服药物的需求。如图2A所示,这是一种通用的平行合成方法来获得高度和随机N-烷基化的类药物环肽,该方法满足了克服三个挑战性问题的复杂要求:DKP(环缩二氨酸)的形成、由于位阻导致酰胺化反应性不足和酸性条件下环肽的不稳定性。JMC报道了两种不同酸强度的反应条件,以保持酸不稳定的类药环肽的稳定性;利用该方法合成出来4000多条环肽,最终发现了临床环状肽LUNA18,当时这篇JMC并未提到根据哪个hit进行优化,重点在于报道合成方法的突破。整条路线下来,能达到31%的收率和终产物97%的纯度。
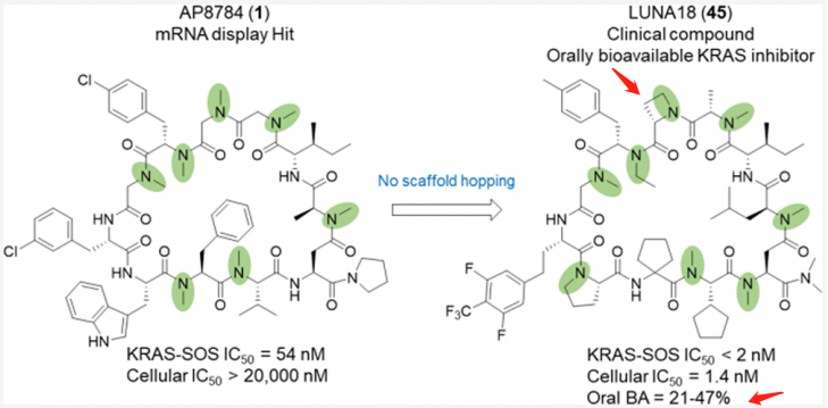
如图3所示,Chugai公司经过筛选,从mRNA展示文库中的AP8747未经骨架跃迁,经过化学优化,围绕着增加多肽的血浆稳定性、改善吸收、降低清除、减少氢键给体;最终发现了具有口服生物利用度的临床化合物LUNA18(减少了两个氢键供体),这是一种针对细胞内的靶点RAS的11-mer环肽抑制剂。
亮点发现主要在以下几点:(i)鉴定出两个肽侧链,每个侧链将RAS亲和力提高10倍以上;(ii)包括Clog P在内的理化性质可通过侧链修饰来调节,以增加膜的通透性;(iii)限制环肽构象可有效调节多肽的理化性质,提高生物活性;(iv)在Caco-2渗透性试验中,观察到渗透性提升到0.4×10−6 cm/s及以上并使得细胞活性从AP8784的20000nM以上提升到LUNA18的1.4nM,提高14000倍以上;(v)微观上确认了,在保持环肽主链构象不变时,RAS蛋白的结构可通过诱导与肽侧链的匹配而发生巨大的变化。
然而,比较可惜的是文章中并未给出LUNA18的动物PK数据,在后续的文章中将披露更多的数据(A platform to create oral drugs beyond rule of 5 for intracellular tough targets. J. Am. Chem. Soc., Submitted)。这篇JACS只给出了化合物40的小鼠PK数据,如图4所示,5mpk iv给药下暴露量有65200ng h/ml,半衰期达到3个小时以上,Vss只有0.2L/kg;但是放大10倍剂量口服后,小鼠的暴露量却还达不到iv的效果,生物利用度只有7.6%,这显然未达到口服药物的要求。虽然索马鲁肽的口服生物利用度只有0.8%,这会给制剂带来巨大的挑战。化合物40仍然需要对吸收和清除进一步优化。

如图5所示,化合物40和LUNA18只在四个氨基酸上有差别。参考SAR具有以下三个特征:(i)位置5的侧链更倾向于芳香而不是脂肪族;(ii)在11号位置可以调整PCP;(iii)调整位置7和10的氨基酸可增强生物活性。在这个策略的指导下,把化合物40的5位置的环己烷基改为对甲苄基;7位置上的氯三氟甲基苯环改为二氟三氟甲基苯环;位置10的异丙基改为了环戊基;11位置则把甲基改为了N,N-二甲酰胺基。化合物45的细胞IC50为1.4 nM (AsPC-1),Caco-2 Papp为2.3×10−6 cm/s。相比化合物40,各方面数据有了整体提升。

除了AsPC-1外,化合物45对KRAS基因改变的细胞系,都显示出显著的细胞活性(IC50=0.17-2.9nM)。如LS180(结肠癌,KRASG12D)、GSU(胃癌,KRASG12D)、NCI-H441(非小细胞肺癌,KRASG12V)、NCI-H2122 (非小细胞肺癌, KRASG12C)和MiaPaCa-2(胰腺癌,KRASG12C)。
在NCI-H441或MiaPaCa-2异种移植物小鼠中评估了luna-18的体内疗效。化合物luna18每天口服1次,连用14 d,测定小鼠体重和肿瘤体积。在剂量为10 mg/kg时,观察到肿瘤消退,且没有明显的体重减轻。
在小鼠、大鼠、猴子和犬体内进行了luna18的PK研究。经口服给药后,化合物luna18在这4种动物体内的生物利用度为21-47%。这些结果表明,luna18这种环肽作为一种口服药物具有治疗潜力,可以治疗含有KRAS基因突变的多种癌症。目前,45 (LUNA18)正在日本/美国进行一期临床试验。
值得关注的是,本篇文章中的环肽分子对KRASG12D突变的细胞具有非常强效的抑制活性,体内药效的情况目前没有数据披露,如果体内药效也能保持强效,这必然会加强KRASG12D口服抑制剂的内卷。吸引国内外众多公司follow这类环肽抑制剂。
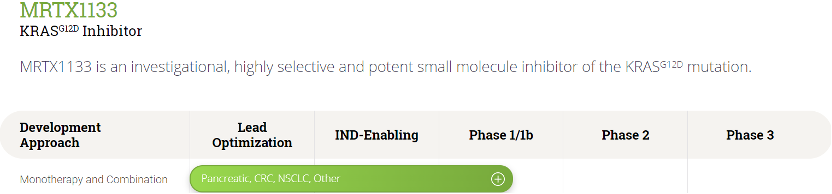
KRASG12D突变影响了美国和欧洲约18万名患者,与KRASG12C突变相比,患病率增加了约2.5倍。目前尚无针对这些患者的靶向肿瘤治疗方案。在临床前KRASG12D突变的胰腺癌模型以及肺癌和结直肠癌模型中,MRTX1133给予显著的肿瘤应答。MRTX1133具有良好的药物特性,包括脱靶活性和药物相互作用的低风险,预计人体半衰期大于50小时。
目前,全球仅MRTX1133一款口服G12D抑制剂于2023年1月获得FDA批准,正在临床I/Ib进行研究,恒瑞此前申报的KRASG12D抑制剂也是一款注射药物,其他口服G12D抑制剂均处于临床前研究阶段。MRTX1133已发现两年之久,文章也报道多时,但由于口服生物利用度极低,一直未能申报IND,最后通过制剂手段实现了口服给药,但AUC也仅仅提高了10倍左右,生物利用度仍然很低,存在很大的优化空间。
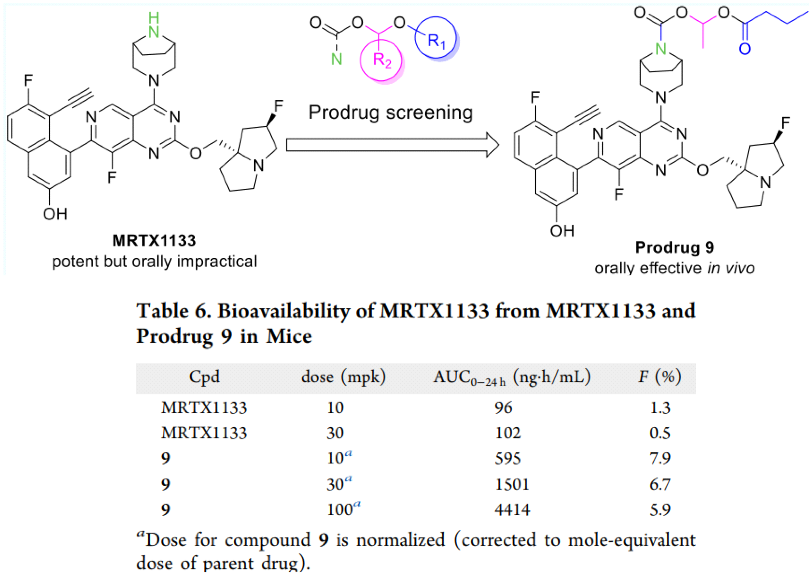
此外,如图7,上海润佳医药报道了前药策略改善MRTX1133的口服生物利用度,把MRTX1133做成氨基甲酸酯衍生物的形式。前药9与母体化合物相比在小鼠体内表现出改善的药代动力学特性(F由0.5-1.3%提升到6.7-7.9%),并且口服KRASG12D突变异种移植小鼠肿瘤模型有效。
前药策略虽能改善化合物的理化性质、PK性质,以及增加药物研发的可靠性和有效性等,但由于前药的研究涉及到不同于“正常”药物诸如合成、药效、药代及毒理等方面的研发过程,这些都是未知的风险,故而必须慎重选择。
总之,KRAS G12D抑制剂的开发存在很高的技术壁垒,不仅要突破G12D难成药的障碍,还要解决口服PK差的难题。面对这迫切的未满足的临床需求,对各大制药公司来说,口服KRAS G12D抑制剂的开发既是重大挑战也是难得的机遇。

参考资料:
1.Mikimasa Tanada et.al; Development of Orally Bioavailable Peptides Targeting an ntracellular Protein: From a Hit to a Clinical KRAS Inhibitor. https://doi.org/10.1021/jacs.3c03886.
2.Kenichi Nomura et al;Broadly Applicable and Comprehensive Synthetic Method for N-Alkyl-Rich Drug-like Cyclic Peptides.J. Med. Chem. 2022, 65, 13401−13412.
3.Xiang Ji et al; Discovery of Prodrug of MRTX1133 as an Oral Therapy for Cancers with KRASG12D Mutation,ACS Omega 2023, 8, 7211−7221.
4.https://mp.weixin.qq.com/s/w4iUxY0plB8uGTn_caLyGg.
5.mirati官网.



