预约演示
更新于:2025-05-07
Hepatitis C
丙型肝炎
更新于:2025-05-07
基本信息
别名 C型急性肝炎、C型肝炎、Cガタウイルスセイカンエン + [66] |
简介 INFLAMMATION of the LIVER in humans caused by HEPATITIS C VIRUS, a single-stranded RNA virus. Its incubation period is 30-90 days. Hepatitis C is transmitted primarily by contaminated blood parenterally and is often associated with transfusion and intravenous drug abuse. However, in a significant number of cases, the source of hepatitis C infection is unknown. |
关联
635
项与 丙型肝炎 相关的药物作用机制 NS5B polymerase抑制剂 |
在研机构 |
原研机构 |
非在研适应症- |
最高研发阶段批准上市 |
首次获批国家/地区 中国 |
首次获批日期2025-03-25 |
靶点 |
作用机制 NS5A抑制剂 |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段批准上市 |
首次获批国家/地区 中国 |
首次获批日期2025-02-08 |
作用机制 NS5B polymerase抑制剂 |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段批准上市 |
首次获批国家/地区 中国 |
首次获批日期2023-05-12 |
3,312
项与 丙型肝炎 相关的临床试验NCT06766331
Integrating Infectious Diseases Screening and Treatment With Medication Assisted Therapy for Veterans With Opioid Use Disorder
Opioid use disorder (OUD) confers a higher risk of acquiring and transmitting infectious diseases, which may have long-term health consequences in Veterans. Treatment of OUD with medication assisted therapy is highly effective, however this often occurs independently of infectious diseases care. This project will test out a new model that combines infectious diseases and OUD care within one VA clinic appointment. This new care model may improve the health of Veterans and reduce cost and time required for Veterans who often need to attend multiple outpatient appointments.
开始日期2028-04-03 |
NCT03767231
Emergency Department Patient's Perceptions and Acceptability Toward a Novel Point-of-Care Hepatitis C Virus Viral Load Testing
Hepatitis C virus (HCV) infection has become the leading fatal infectious disease in the United States. Approximately 75% of individuals who have been infected with HCV are chronically infected with the virus. Untreated chronic infection will lead to severe sequelae such as cirrhosis and hepatocellular carcinoma. Even though the availability of rapid HCV antibody (HCV Ab) screening assay and highly effective antiviral treatment, most people infected with HCV are not aware of the infection status. This gap mainly comes from the current gold standard confirmatory testing for chronic HCV infection, the Polymerase Chain Reaction (PCR)-based HCV RNA viral load assay which requires an experienced trained laboratory technician to perform relatively complicated PCR assay with a turn-around-time of 1 to 2 days (from provider's order to the test resulting). The investigators' rapid HCV Screening and Linkage to Care program has demonstrated that many patients in the investigators' emergency department (ED) are unaware of patient's chronic HCV infection status due to the barriers to receive the gold standard viral load testing.
Recently, a novel Xpert HCV Viral Load (VL) Finger-stick (FS) [Xpert HCV VL FS] point-of-care (POC) test (Cepheid) has been developed. In an observational cohort in Australia, HCV RNA was detected in 40% of participants (85 of 210) enrolled at 3 drug treatment clinics and 1 homelessness service. Sensitivity of the Xpert HCV VL FS assay for HCV RNA quantification in samples collected by finger-stick was 100.0% (95% Confidence Interval (CI), 93.9%-100.0%) and specificity was 100.0% (95% CI, 96.6%-100.0%). The Xpert HCV VL FS test can accurately detect active infection from a finger-stick sample in 1 hour allowing single-visit HCV diagnosis.
In this protocol, the investigators seek to determine the needs and acceptability of a novel POC HCV viral load testing assay among ED HCV Ab positive patients. For this project, the investigators will identify and enroll ED patients with HCV Ab positive but without HCV viral information. The investigators will conduct a randomized study to assign eligible and consented patients to either to POC Testing Group or Standard of Care (SOC) Group. All participants will take a short survey regarding HCV care and treatment. As part of the investigators' ED HCV Screening and Linkage to Care Program, all participants will receive the standard-of-care clinical laboratory-based HCV RNA viral load testing via whole blood (i.e. patient will receive blood drawn). This standard-of-care HCV viral load testing result will be provided to participant when it is available (usually 1-2 days later). Participants in the POC Testing Group will receive the novel POC HCV RNA viral load testing and the result of the novel test will be disclosed to the patients approximately within 2 hours of the testing. Linkage to care information after the ED visit will be compared between two groups. Finally, accuracy of this POC HCV RNA viral load testing in the acute care setting will be determined as compared to the standard-of-care clinical laboratory-based HCV RNA viral load testing. The investigators will also ask all of participants to grant permission to use the remnant blood specimens for an evaluation of future in-house HCV RNA viral load assay.
Recently, a novel Xpert HCV Viral Load (VL) Finger-stick (FS) [Xpert HCV VL FS] point-of-care (POC) test (Cepheid) has been developed. In an observational cohort in Australia, HCV RNA was detected in 40% of participants (85 of 210) enrolled at 3 drug treatment clinics and 1 homelessness service. Sensitivity of the Xpert HCV VL FS assay for HCV RNA quantification in samples collected by finger-stick was 100.0% (95% Confidence Interval (CI), 93.9%-100.0%) and specificity was 100.0% (95% CI, 96.6%-100.0%). The Xpert HCV VL FS test can accurately detect active infection from a finger-stick sample in 1 hour allowing single-visit HCV diagnosis.
In this protocol, the investigators seek to determine the needs and acceptability of a novel POC HCV viral load testing assay among ED HCV Ab positive patients. For this project, the investigators will identify and enroll ED patients with HCV Ab positive but without HCV viral information. The investigators will conduct a randomized study to assign eligible and consented patients to either to POC Testing Group or Standard of Care (SOC) Group. All participants will take a short survey regarding HCV care and treatment. As part of the investigators' ED HCV Screening and Linkage to Care Program, all participants will receive the standard-of-care clinical laboratory-based HCV RNA viral load testing via whole blood (i.e. patient will receive blood drawn). This standard-of-care HCV viral load testing result will be provided to participant when it is available (usually 1-2 days later). Participants in the POC Testing Group will receive the novel POC HCV RNA viral load testing and the result of the novel test will be disclosed to the patients approximately within 2 hours of the testing. Linkage to care information after the ED visit will be compared between two groups. Finally, accuracy of this POC HCV RNA viral load testing in the acute care setting will be determined as compared to the standard-of-care clinical laboratory-based HCV RNA viral load testing. The investigators will also ask all of participants to grant permission to use the remnant blood specimens for an evaluation of future in-house HCV RNA viral load assay.
开始日期2025-11-01 |
申办/合作机构 |
NCT06483451
Hepatitis C Virus Management Through Facilitated Telemedicine Integrated Into Opioid Treatment Programs: Catholic Health System Experience
Hepatitis C virus is a leading cause of morbidity and mortality globally with the highest prevalence and incidence among people with opioid use disorder. We aim to establish facilitated telemedicine as a standard of care treatment approach at 3 opioid treatment programs operated by the Catholic Health System. This study is a chart review data analysis to evaluate outcomes of facilitated telemedicine integrated into opioid treatment programs and to evaluate the number of individuals who initiate and complete treatment for hepatitis C virus infection.
开始日期2025-07-01 |
100 项与 丙型肝炎 相关的临床结果
登录后查看更多信息
100 项与 丙型肝炎 相关的转化医学
登录后查看更多信息
0 项与 丙型肝炎 相关的专利(医药)
登录后查看更多信息
81,765
项与 丙型肝炎 相关的文献(医药)2025-12-31·Expert Review of Vaccines
Towards an HCV vaccine: an overview of the immunization strategies for eliciting an effective B-cell response
Review
作者: Sautto, Giuseppe A. ; Costa, Gabriel L.
2025-12-31·Journal of Medical Economics
Patient and physician preferences for treatment of hepatitis C virus infection in Japan: a discrete choice experiment
Article
作者: Makhija, Dilip ; Kwon, Kyung min ; Piao, Yi ; Jinushi, Masahisa ; Chikamura, Yunosuke ; Mizutani, Hajime ; Zagorski, Jamie ; LoPresti, Michael ; Eguchi, Yuichiro ; Nakamoto, Daisuke
2025-12-31·Annals of Medicine
Risk factors for hepatocellular carcinoma: an umbrella review of systematic review and meta-analysis
Review
作者: Jiang, Keting ; Wang, Haibiao ; Zhou, Songsheng ; Wang, Jie ; Qiu, Kaijie ; Wang, Donghuan ; Gan, Yichao
1,586
项与 丙型肝炎 相关的新闻(医药)2025-04-30
·药学进展
“点击蓝字 关注我们潘国宇上海微知卓生物科技有限公司董事长,中国科学院上海药物研究所研究员,中国药科大学博士。曾在美国波士顿诺华研究院担任高级研究员,回国后就职于中国科学院上海药物研究所,从事药物肝脏代谢、毒性机制和细胞治疗等研究工作,发表SCI期刊学术论文50余篇。现为中国药物代谢委员会委员、中国细胞治疗研究与应用协会常任理事、国家“生物人工肝”重大专项首席科学家。创立微知卓公司后,主要进行肝脏疾病的细胞治疗、生物人工肝临床转化研究。人多能干细胞国际标准与国内团体标准的对比解析 PPS 王莹1,田娥1,周冰洁1,郭新颖1,潘国宇1,2*(1.上海微知卓生物科技有限公司,上海 200135;2.中国科学院上海药物研究所,上海 201203)[摘要]干细胞研究和产业化是当今生物医学基础研究和成果转化领域前沿方向之一,然而国内外研究和转化标准并不统一。介绍了多能干细胞的定义与研究概况,并对国际干细胞研究学会(ISSCR)发布的《人干细胞基础研究标准》以及中国细胞生物学学会发布的《人胚干细胞》与《人诱导多能干细胞》团体标准进行介绍和比较分析,旨在为我国干细胞基础研究和产品转化提供参考。1引言2023年6月,国际干细胞研究学会(ISSCR)发布了《人干细胞基础研究标准》(Standards for Human Stem Cell Use in Research)[1],该项国际学术团体标准为从事人类干细胞研究的相关人员制定了基础的研究标准;中国细胞生物学学会在2019年发布《人胚干细胞》团体标准[2](2020年修订),2021年发布了《人诱导多能干细胞》团体标准[3]。前者针对干细胞研究初步规划直至论文发表这一过程中应完成的研究活动进行了建议;后者对干细胞研究走向产业化的过程中生产和检测的重要考察指标进行了规范化建议。尽管国内外科研和产业化背景差异较大,标准的受众关注点却有交叉。例如,在美国,科研工作者完成研究工作后,往往以与公司合作的方式进行产业转化,其标准虽被标注为研究而设计,但也考虑了后续产业化的需求;而在我国,干细胞研究的产业化工作很多是由基础科研人员主导,因此我国现阶段制定的产业化干细胞研究标准往往有浓厚的科研痕迹。此外,ISSCR发布的《人干细胞基础研究标准》的制定有我国科技工作者的深度参与,该标准的基本逻辑和我国的两项团体标准具有相通之处。本文介绍了多能干细胞的基本定义,国内外临床研究进展,法规、伦理的演进和发展侧重点,并对上述3项干细胞标准的制定背景、主要内容和使用场景进行对比,分析异同产生的原因,旨在为我国干细胞研究工作提供参考。2多能干细胞的定义和研究概况多能干细胞主要包括诱导多能干细胞(iPSC)和胚胎干细胞(ESC)。iPSC是将多个转录因子导入到成熟体细胞中,并使其重编程为具有类似胚胎干细胞特征的细胞;ESC是从早期胚胎的内部细胞团(ICM)中分离出来的细胞。尽管人ESC(hESC)在临床上展现出比iPSC更好的效果,但由于hESC来源于人类胚胎,其应用受到了限制。相比之下,iPSC免疫原性较低,可降低免疫排斥风险,且减少了干细胞研究在伦理方面的争议,在再生医学、疾病建模、药物开发以及细胞治疗等领域应用广泛[4]。截至2024年3月,ClinicalTrials.gov上检索到的有关iPSC的临床试验有164项,主要集中在神经系统疾病[5]、心血管疾病[6]、代谢性疾病[7-10]、眼科疾病[11]和癌症等领域[12-14]。由CynataTherapeutics开发的用于治疗骨关节炎的CYP-004是全球首个进入Ⅲ期临床的iPSC衍生产品。目前共有48项注册的临床试验将源于hESC的细胞用于各类疾病的治疗,其中,有24项试验基于hESC来源的视网膜色素上皮细胞治疗黄斑变性;4项试验将hESC分化为间充质干细胞(MSC)或MSC样细胞并用于治疗多发性硬化症、间质性膀胱炎、原发性卵巢功能不全以及半月板损伤;4项试验将hESC分化为胰腺祖细胞或胰腺上皮细胞并用于1型糖尿病治疗;其余试验将hESC分化后的细胞用于治疗慢性缺血性左心室功能不全、脊髓损伤、帕金森病、缺血性脑卒中等。首个与hESC相关的临床试验注册于2002年。2012年以后,hESC相关临床试验注册数量显著上升。目前,注册数量最多的是美国,其次是中国。与眼科疾病相关的hESC临床试验占比最高,其次是神经系统疾病,以Ⅰ期或Ⅰ/Ⅱ期临床试验为主[15]。目前,多能干细胞治疗疾病的相关探索正在进行中。在临床前阶段,多能干细胞已经被成功分化为多种类型细胞,且其疗效已在动物模型中得到了验证。多项基于多能干细胞治疗疾病的临床试验已启动。尽管已取得显著进展,但多能干细胞仍存在一些问题。Yamanaka[16]在2020年的综述中提到了多能干细胞治疗面临的3个主要挑战:安全性、免疫原性和异质性。除了技术方面的挑战,干细胞研究还会面临伦理问题。hESC通常来自体外受精(IVF)程序捐赠的剩余胚胎。在符合人类利益如治疗疾病的情况下,我国支持对人类胚胎和hESC进行研究。因此2003年我国发布的《人胚胎干细胞研究伦理指导原则》明确规定研究人员在hESC及iPSC的获取、改造与应用过程中应认真对待捐献者的知情同意情况、福利和权利以及潜在风险和益处等,并严格按照伦理指导原则中的要求执行。除了道德伦理上的考虑,人类胚胎的法律地位可能也会影响胚胎和干细胞研究政策和法规。根据我国法律,人类胚胎不被视作一个人,但人的胚胎是介于人与物质之间的特殊物质,它应该比无生命的物体具有更高的道德伦理地位,应该得到特殊的尊重和保护。《人胚胎干细胞研究伦理指导原则》自发布施行至今已有20年未更新,若干细胞伦理政策导向在未来有所变化,将会对该研究领域相关法律法规产生深远影响。此外,在2019年之前,我国对胚胎干细胞相关研究不予专利保护。直到2019年4月,国家知识产权局对外公布了《专利审查指南修改草案(征求意见稿)》,其中修改了人胚胎干细胞相关规定,不再对“未经过体内发育的受精14天以内的人类胚胎分离或者获取干细胞技术”的专利保护以专利法第5条为由完全排除,同时明确人胚干细胞不属于处于各个发育阶段的人体。随着干细胞研究领域的发展,国内外均对干细胞专利适用性做出调整,《专利审查指南》的修改体现了我国鼓励再生医疗技术领域发展、支持干细胞技术专利保护的政策动向,旨在激励干细胞研究的创新。3国际干细胞研究学会标准与国内干细胞团体标准的比较我国细胞治疗技术发展迅速,在这一过程中需要制定统一标准并对产品进行监督管理。2019年中国细胞生物学学会发布了《人胚胎干细胞》团体标准[17],2020年修订了该团体标准,更名为《人胚干细胞》[2]。2021年中国细胞生物学学会发布《人诱导多能干细胞》团体标准[3]。以上两项标准规定了人多能干细胞的技术要求、检测方法、使用说明、标签、包装、存储、运输和废弃物处理要求,适用于人多能干细胞的生产和检测。2023年6月,ISSCR发布了《人干细胞基础研究标准》。该标准主要确定了成体干细胞和多能干细胞的实验室使用的质量标准,内容共分为5个部分:第一部分介绍了人类干细胞获取/生成、保存和早期表征的关键原则;第二部分介绍如何定义和表征人类多能干细胞;第三部分提倡监测干细胞在储存和培养过程中是否发生了遗传变化;第四部分主要阐述提高模型系统在基础研究中的实用性的方式;第五部分重点强调了涉及多能干细胞或组织干细胞的论文中应报告的必要细节。以下将对ISSCR标准与国内干细胞团体标准进行比较。3.1 国际干细胞研究学会标准与国内干细胞团体标准的相同点ISSCR标准与国内干细胞团体标准对多能干细胞研究与生产过程中涉及的多个关键步骤以及质量属性提出了类似的建议。3.1.1 细胞原材料获取 3项标准均要求对细胞原材料进行人类病毒病原体[包括Ⅰ型人免疫缺陷病毒(HIV-Ⅰ)、Ⅱ型人免疫缺陷病毒(HIV-Ⅱ)、乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)等]筛查。多能干细胞构建成功后也需进行微生物检测,包括真菌、细菌、支原体、HIV-Ⅰ、HIV-Ⅱ、HBV、HCV、人类T细胞白血病病毒(HTLV)、爱泼斯坦-巴尔病毒(EBV)、人类巨细胞病毒(HCMV)和梅毒螺旋体(TP),这些病原体均应为阴性。国内干细胞团体标准规定在获取细胞原材料并进行研究时应遵守《T/CSCB0001干细胞通用要求》[19]。另外,研究人员构建及使用人胚干细胞时还应遵守2003年发布的《人胚胎干细胞研究伦理指导原则》[18]。ISSCR标准强烈建议原材料获取时必须遵守国内法律法规,但理想情况下,还应验证是否符合ISSCR等相关机构提出的国际原则《ISSCR干细胞研究和临床转化指南:2021年更新》(ISSCR Guidelines for Stem Cell Research and Clinical Translation: The 2021 update)。国内干细胞通用标准要求干细胞的来源应符合研究者所在国认可的伦理和当地的法律法规,材料获取前应严格审查。干细胞材料供者应签署书面合法有效的知情同意书,以保护受试者的隐私等。并且,国际以及国内干细胞指导原则均明确规定:1)研究者禁止进行生殖性克隆人任何研究;2)用于研究的人胚胎干细胞只能来源于体外受精时多余的配子或囊胚,自然或自愿选择流产得到的胎儿细胞,体细胞核移植技术所获得的囊胚和单性分裂囊胚,自愿捐献的生殖细胞;3)利用体外受精、体细胞核移植、单倍体复制技术或遗传修饰获得的囊胚,其体外培养期限自受精或核移植开始不得超过14天;4)不得将人的生殖细胞与其他物种的生殖细胞结合。3.1.2 定义和表征人类多能干细胞 3项标准均建议检测未分化多能干细胞表达的细胞表面标记物,如阶段特异性胚胎抗原(SSEA)3、SSEA4、TRA-1-60、TRA-1-81等。ISSCR标准强烈建议进行短串联重复序列(STR)分析来鉴定染色体核型。国内干细胞团体标准也明确规定细胞产品STR检测结果应与供者细胞保持一致,外源重编程基因检测结果应为阴性。3.1.3 细胞存储 ISSCR标准建议使用双生物库系统并在场外保护部分具有特征的主细胞库(MCB),以防止当地灾难性事件造成的损失。国内干细胞团体标准及其相关参考标准同样提议,为防止不可抗性因素所导致的损坏或丢失,应将同一来源的细胞进行“镜像保存”(即分成若干份,分放不同区域的不同容器中长期保存)。3.1.4 其他方面 ISSCR发布的《人干细胞基础研究标准》对使用干细胞构建细胞疾病模型提出相关建议,包括:应尽早表征材料的来源组织或细胞;在当地法规允许的情况下,应考虑捐赠者的性别、年龄、种族和遗传背景、健康状况、风险因素以及任何其他临床体征或症状;在将疾病模型与健康对照进行比较时,应明确界定“健康”的含义等。另外,在涉及多能干细胞或组织干细胞的论文中应报告的必要细节,包括细胞系的来源或其衍生的细胞系、干细胞维持和保存的方法以及传代次数的注册号等。论文中应彻底描述细胞多能性和未分化状态的测试,包括测定方法、试剂来源、数据、定量和统计分析,并应指出细胞系培养过程中进行测定的时间点。3.2国际干细胞研究学会标准与国内干细胞团体标准 的主要不同点ISSCR标准与国内干细胞团体标准在人类多能干细胞原材料获取、人类多能干细胞的定义和表征、细胞标签内容的规范,以及废弃物处理方面均有所不同,表1对此进行了初步梳理和分析。4讨论ISSCR的《人干细胞基础研究标准》主要针对干细胞研究活动提供了建议和指导,内容涵盖获取干细胞要求、干细胞培养时的监测以及最终论文发表等方面。《人诱导多能干细胞》团体标准和《人胚干细胞》团体标准较为相似,主要对产业化过程中干细胞产品的生产和检测重要考察指标进行规范化建议。这种差异和两类标准的制定目的有关。ISSCR的《人干细胞基础研究标准》主要针对欧美干细胞工作者提供科研方面的基础指导。在欧美国家,尤其是美国,科研工作者完成研究工作后,也会进行产业转化,但是产品后期开发主要以公司形式完成,因此产业化初期阶段只要考虑产业化的基本需求即可。而在我国,许多干细胞研究由基础科研人员主导,一旦有所突破,往往是由基础科学家直接开展临床研究,尤其是医疗机构的科研人员会独立开展“前店后厂”式的科研服务(参考国家卫生健康委员会于2015年颁布的《干细胞临床研究管理办法(试行)》),产业化进程和科研进程是同步进行的。因此我国现阶段制定的干细胞研究标准规范基于对科研工作者的研究要求,同时又包含产业化的许多具体要求。建议科研人员根据自己的实际需求,在工作中灵活运用不同标准来指导工作。国际方面,以Fatetherapeutics产品——iPSC来源T细胞的研究为例。产品从获取供体细胞开始构建完整的动态药品生产管理规范(current Good Manufacture Practices,cGMP)iPSC细胞系,获取时遵循相关的ISSCR指南,包括请供体签署书面和合法有效的知情同意书。为确保iPSC主产物的质量(如无菌性和遗传稳定性等),需按ISSCR标准建立质量控制测试和放行标准[22]。国内方面,以中盛溯源研制的iPSC来源自然杀伤细胞(NK)产品为例。该产品使用的干细胞库的构建,以及生产质量控制均须按国内干细胞团体标准规定执行,包括染色体核型、STR分析、细胞标志物检测、无菌检测、支原体检测、内毒素检测、病原体检测、畸胎瘤形成以及三胚层分化检测等。需要指出的是,国内外标准仅为相关从业人员提供最基础的必须遵守的标准,以确保研究和应用的安全性和有效性。ISSCR发布的《人干细胞基础研究标准》其基本逻辑与我国的两项团体标准具有许多相通之处,这是因为此标准的制定有我国科技工作者的深度参与。我国两项干细胞团体标准的前期经验,为该标准的制定提供了宝贵经验。这充分说明,我国科学研究与世界联系已非常紧密,随着我国科研的迅速发展,我国科技工作者在世界上的声音会越来越响亮。根据《“健康中国2030”规划纲要》,干细胞技术被视为医学前沿技术的重点发展方向之一。未来干细胞技术将在技术研发和转化方面取得更多突破,推动临床应用的进展。随着技术进步和市场需求的增长,干细胞治疗产业链的各个环节都将得到进一步的发展和完善。国家高度重视干细胞行业的发展,并多次提出大力发展干细胞技术,预计未来将有更多的政策支持,包括资金投入、税收优惠等,以促进干细胞技术的研究和产业化。目前,干细胞产品按药品进行管理,形成了药品监管部门、卫生健康管理部门“双重监管”的管理体系。许多企业在进行药品临床试验注册申请前,已与医疗机构合作开展了临床研究。药品审评中心(CDE)于2017年发布《细胞治疗产品研究与评价技术指导原则(试行)》,对细胞治疗产品按照药品管理相关法律法规进行研发时的技术要求进行了总体阐述。CDE于2023年发布了《人源干细胞产品药学研究与评价技术指导原则(试行)》《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》,2024年发布了《人源干细胞产品非临床研究技术指导原则》,上述指导原则的发布表明我国干细胞产品监管标准逐步完善,也为企业后续按照药品注册路径申报临床试验所涉及的研究活动提供了政策依据以及指引。附录:中国干细胞相关标准的发展历程近年来,我国科研技术不断创新突破,国家政策逐渐深入引导,我国干细胞技术快速发展,深受国际的认可。我国研究者是国际科技研究和转化应用领域第一阵营的主要力量之一,参与制定的指导原则、标准以及法规为从事干细胞研究的国内外同行规定了多能干细胞的建系培养、生物学特性鉴定、质量控制、信息管理、分发和运输等方面的要求。科技部和卫生部于2003年联合发布《人胚胎干细胞研究伦理指导原则》[18],中国细胞生物学会于2017年8月发布《干细胞通用要求》团体标准[19],2020年发布《人胚干细胞》团体标准修订版[2],2021年1月发布《人诱导多能干细胞》团体标准[3],2022年8月发布《人干细胞研究伦理审查技术规范》团体标准[21],这些标准为国内从事多能干细胞研究的全体成员提供了生产、检测和质量控制以及伦理审查的标准,推动了我国干细胞领域标准化与规范化发展。2022年10月,我国研究者牵头制定了国际标准《人和小鼠多能性干细胞通用要求(ISO24603)》[21],这是国际标准化组织生物技术委员会的第一个干细胞标准,也是全球首个干细胞国际标准,标志着我国干细胞基础和转化研究以及标准建设走在国际前列。致谢:特别感谢中国科学院上海生命科学院上海生物化学和细胞研究所惠利健教授,中国科学院动物研究所赵同标教授、郝捷教授等提出的宝贵意见。参考文献:[1] International Society for Stem Cell Research. Standards for Human Stem Cell Use in Research[EB/OL]. (2023-06-06)[2023-08-10]. https://www.isscr.org/basic-research-standards.[2] 中国细胞生物学学会 . T/CSCB 0002—2020《人胚干细胞》团体 标准 [S]. 北京 : 中国标准出版社, 2020.[3] 中国细胞生物学学会 . T/CSCB 0005—2021《人诱导多能干细胞》 团体标准 [S]. 北京 : 中国标准出版社, 2021.[4] Karagiannis P, Takahashi K, Saito M, et al. Induced pluripotent stem cells and their use in human models of disease and development[J]. Physiol Rev, 2019, 99(1): 79-114.[5] Bassil R, Shields K, Granger K, et al. Improved modeling of human AD with an automated culturing platform for iPSC neurons, astrocytes and microglia[J]. Nat Commun, 2021, 12(1): 5220. DOI:10.1038/s41467-021-25344-6.[6] Zimmermann W H, Tissue engineered heart repair from preclinical models to first-in-patient studies[J]. Curr Opin Physiol, 2020, 14: 70- 77.[7] Csobonyeiova M, Polak S, Danisovic L. Generation of pancreatic β-cells from iPSCs and their potential for type 1 diabetes mellitus replacement therapy and modelling[J]. Exp Clin Endocrinol Diabetes, 2020, 128(5): 339-346.[8] Zhang D, Jiang W, Liu M, et al. Highly efficient differentiation of human ES cells and iPS cells into mature pancreatic insulin-producing cells[J]. Cell Res, 2009, 19(4): 429-438.[9] Ogawa M, Ogawa S, Bear C E, et al. Directed differentiation of cholangiocytes from human pluripotent stem cells[J]. Nat Biotechnol, 2015, 33(8): 853-861.[10] Sampaziotis F, de Brito M C, Madrigal P, et al. Cholangiocytes derived from human induced pluripotent stem cells for disease modeling and drug validation[J]. Nat Biotechnol, 2015, 33(8): 845- 852.[11] Mandai M, Watanabe A, KurimotoY, et al. Autologous induced stem- cell-derived retinal cells for macular degeneration[J]. N Engl J Med, 2017, 376(11): 1038-1046.[12] Zhang L, Tian L, Dai X Y, et al. Pluripotent stem cell-derived CAR- macrophage cells with antigen-dependent anti-cancer cell functions[J]. J Hematol Oncol, 2020, 13(1): 153. DOI:10.1186/s13045-020-00983- 2.[13] Lin X T, Sun Y, Dong X, et al. IPSC-derived CAR-NK cells for cancer immunotherapy[J]. BiomedPharmacother, 2023, 165: 115123. DOI:10.1016/j.biopha.2023.115123.[14] Ueda T, Shiina S, Iriguchi S, et al. Optimization of the proliferation and persistency of CAR T cells derived from human induced pluripotent stem cells[J]. Nat BiomedEng, 2023, 7(1): 24-37.[15] Park S J, Kim YY, Han JY, et al. Advancements in human embryonic stem cell research: clinical applications and ethical issues[J]. Tissue Eng Regen Med, 2024, 21(3): 379-394.[16] Yamanaka S. Pluripotent stem cell-based cell therapy-promise and challenges[J]. Cell Stem Cell, 2020, 27(4): 523-531.[17] 中国细胞生物学学会 . T/CSSCR002—2019《人胚胎干细胞》团体标准 [S]. 北京 : 中国标准出版社, 2019.[18] 中华人民共和国科技部和卫生部 . 人胚胎干细胞研究伦理指导原则 [J]. 中国生育健康杂志, 2004, 15(2): 71.[19] 中国细胞生物学学会 . T/CSCB 0001—2020《干细胞通用要求》团体标准 [S]. 北京 : 中国标准出版社, 2020.[20] 中国细胞生物学学会 . T/CSCB 0001—2022《人干细胞研究伦理 审查技术规范》团体标准 [S]. 北京 : 中国标准出版社, 2022.[21] ISO. Requirements for human and mouse pluripotent stem cells[EB/OL].(2022-08-03)[2023-08-30]. https://www.iso.org/obp/ ui#iso:std:iso:24603:ed-1:v1:en.[22] Netsrithong R, Garcia-Perez L, Themeli M. Engineered T cells from induced pluripotent stem cells: from research towards clinical implementation[J]. Front Immunol, 2024, 14: 1325209. DOI:10.3389/ fimmu.2023.1325209.美编排版:张苗苗感谢您阅读《药学进展》微信平台原创好文,也欢迎各位读者转载、引用。本文选自《药学进展》2025年第 3 期。《药学进展》杂志由教育部主管、中国药科大学和中国药学会共同主办,中国科技核心期刊(中国科技论文统计源期刊)。刊物以反映药学科研领域的新方法、新成果、新进展、新趋势为宗旨,以综述、评述、行业发展报告为特色,以药学学科进展、技术进展、新药研发各环节技术信息为重点,是一本专注于医药科技前沿与产业动态的专业媒体。《药学进展》注重内容策划、加强组稿约稿、深度挖掘、分析药学信息资源、在药学学科进展、科研思路方法、靶点机制探讨、新药研发报告、临床用药分析、国际医药前沿等方面初具特色;特别是医药信息内容以科学前沿与国家战略需求相合,更加突出前瞻性、权威性、时效性、新颖性、系统性、实战性。根据最新统计数据,刊物篇均下载率连续三年蝉联我国医药期刊榜首,复合影响因子1.216,具有较高的影响力。《药学进展》编委会由国家重大专项化学药总师陈凯先院士担任主编,编委由新药研发技术链政府监管部门、高校科研院所、制药企业、临床医院、CRO、金融资本及知识产权相关机构近两百位极具影响力的专家组成。联系《药学进展》↓↓↓编辑部官网:pps.cpu.edu.cn;邮箱:yxjz@163.com;电话:025-83271227。欢迎投稿、订阅!往期推荐聚焦“兴药为民·2023生物医药创新融合发展大会”“兴药为民·2023生物医药创新融合发展大会”盛大启幕!院士专家齐聚杭城,绘就生物医药前沿赛道新蓝图“兴药强刊”青年学者论坛暨《药学进展》第二届青年编委会议成功召开“兴药为民·2023生物医药创新融合发展大会”路演专场圆满收官!校企合作新旅程已启航我知道你在看哟
细胞疗法
2025-04-30
Novartis plans to acquire Regulus Therapeutics for $7.00 per share in cash, or $800 million, the microRNA specialist
said
Wednesday.
The biotech’s share price
$RGLS
jumped more than 135% in premarket trading, surpassing the buyout price at more than $7.90 apiece.
Regulus is based in San Diego, which has become a biotech hot spot. It will be the future home to one of Novartis’ new biomedical hubs, the company said earlier this month. The hub is part of a 10-site,
$23 billion investment
in American manufacturing and R&D over the coming five years.
The deal marks the second acquisition of the year for Novartis. The Swiss drug giant brought one of its former experimental cardio medicines back into its fold, purchasing
Anthos Therapeutics
for $925 million upfront in February. Novartis was active on the M&A front in 2024 as well, with five small deals.
For Regulus shareholders, the deal is split about evenly between upfront and down-the-road payments. The shareholders could get an additional $7.00 per share in cash through a contingent value right, which depends on the approval of Regulus’ lead candidate, farabursen. If this is exercised, the total value of the deal is around $1.7 billion.
The deal is slated to close in the second half of this year.
Ionis and Alnylam created Regulus as a joint venture in 2007. The biotech then went public via an IPO in
October 2012
at $4.00 per share.
Over the years, Regulus built up a rich pipeline of pharma partnerships with Sanofi, GSK and AstraZeneca, but the tie-ups eventually fumbled.
Sanofi
culled
a mid-stage program in Alport syndrome after a Phase 2 failure; a
clinical hold
for a different drug in hepatitis C led to challenges in the GSK pact; and AstraZeneca reneged on rights to a
drug for NASH
, the fatty liver disease now known as MASH.
Now, Regulus is headed toward a pivotal trial for farabursen. The oligonucleotide targets miR-17, and it’s being tested as a treatment for autosomal dominant polycystic kidney disease, the most common genetic cause of renal failure.
Phase 1b data in March 2024 led the company’s stock price to skyrocket and an immediate
$100 million
boon to the company’s coffers via a private placement.
In March of this year, Regulus
said
it had an agreement with the FDA on “key components” for a single Phase 3 trial for potential accelerated approval.
Editor’s note: This story has been updated throughout to include additional details.
并购寡核苷酸IPO临床1期
2025-04-30
TDS2025检测自动化、智慧化实验室建设与应用论坛,合作咨询:李欣欣177 0186 0390。点击图片查看TDS2024会后报告。来源:东北证券医药研究团队、宇腾话药01免疫诊断:IVD主流发展方向免疫诊断是IVD最大的细分市场,市场规模增长可期。免疫诊断是以免疫学为基础,利用抗原与抗体互相结合的特异性反应来进行定性或者定量的诊断。免疫诊断增长迅速,占比从2012年的29%增长至2020年的36%,成为市场份额第一的细分领域。从市场规模来看,免疫诊断从2018年的256亿元增长到2021年的440亿元,过去五年平均增速约为20%。未来随着技术进步、产品更新迭代和分级诊疗的推进,免疫诊断市场有望实现快速增长。化学发光优势显著,替代趋势进一步增强。在免疫诊断中,根据原理不同又分为化学发光、酶联免疫、胶体金等技术方法,各有其优势和缺点。早期我国免疫检测以胶体金和酶联免疫为主,但由于灵敏度低等问题逐渐被取代;化学发光因灵敏度高、特异度高等优点受到市场广泛认可,占比逐渐升高,目前市场份额最大,是未来免疫诊断的发展方向。目前大城市的大型三级医院已经完成了化学发光取代胶体金和酶联免疫,部分经济欠发达地区的三级医院和多数二级医院仍存在替代空间。根据发光原理不同,化学发光光免疫诊断技术可分为酶促化学发光、直接化学发光、电化学发光三大技术平台,不同细分发光平台的发光原理、试剂配方均有较大差别。酶促化学发光采用辣根过氧化物酶(HRP)或碱性磷酸酶(ALP)作为发光标记物,鲁米诺和双氧水或金刚烷作为发光底物;直接化学发光采用非酶的小分子有机化合物作为发光标记物,如吖啶酯、异鲁米诺等,化学发光过程数秒钟完成,与环境温度的变化无关;电化学发光是以三联吡啶钌作为标记物,在三丙胺与电压的作用下发生电化学反应,发出可见光。化学发光市场发展迅速,增速维持较高水平。化学发光作为免疫诊断的新兴检测技术,由于无放射性、特异性高、灵敏度高、自动化等优点被广泛应用于多种检测场景,发展迅速。中国化学发光市场从2016年的119.3亿元增长到2020年的284.4亿元,年均复合增长率高达24%。随着化学发光方法对酶联免疫、胶体金方法的替代和分级诊疗的推动,未来化学发光的市场将进一步扩大,预计2025年将达到632.6亿元,2021E-2025E的年均复合增长率为17.9%,仍然保持高速发展态势。罗雅贝西占据国内主要市场,国产替代空间巨大。化学发光具有较高的技术壁垒,国外品牌的市场先发优势明显,品牌知名度及依赖度高,在国内市场长期占据主导地位,2021年罗氏、雅培、西门子、贝克曼共占据77%的市场。国内企业市场份额领先的企业有新产业、安图和迈瑞,分别占据6.2%,3.8%,3.2%的市场。随着国内企业在仪器、试剂、流水线上不断取得研发突破,外加集采政策和分级诊疗等政策助力,国产品牌有望占领更大市场份额。国产仪器性能媲美外资。大型化学发光仪器主要在三级医院安装,由于患者众多,医院对仪器的检测速度、检测容量指标特别重视。从检测速度来看,国产品牌仪器能够比肩国际品牌,甚至有些产品已经实现超越,如新产业的MAGLUMI X8和安图的A6000检测速度能达到600T/h。从样本位和试剂位上看,国内厂家也逐步接近国际厂家,其中迈瑞仪器的样本位达到最高300个,安图仪器的试剂位达到最高50个,比肩雅培和贝克曼。国产企业积极推进装机进院,抢占市场份额。2022年新产业、安图、迈克、亚辉龙四家发光头部企业新增装机均超过1000台,装机速度加快,市场仪器保有量进一步提升,有望形成仪器带动试剂销售,试剂促进仪器装机的良性循环。高速机对新装机量的提升起到重要带动作用,截止2022年底,国产企业中新产业是国内累计装机最多的企业,其高速机X8占比由2020年的30.3%迅速提升至2022年的50.4%,有效带动了新产业整体装机,实现装机量持续突破。随着疫情放开,常规诊疗恢复,医疗终端的仪器采购需求释放,国内厂家将保持较高的装机速度,打开终端市场。国产企业术有专攻,特色菜单有望加快进院。国产企业在试剂数量和种类上有一定优势,各个企业也有其深耕的项目类别,从而形成细分病种的龙头,如亚辉龙的自身免疫病项目,新产业和迈瑞的肿瘤标志物项目以及安图的呼吸道项目等。由于化学发光多数采用封闭检测系统,医院使用的仪器和试剂必须为同一厂家。国内品牌通过不断扩大试剂菜单范围,增加特色品种进入医院,进而带动其他病种试剂收入,从而占据更多市场份额。02生化诊断:国产化率高的红海市场生化诊断是利用酶类、糖类、脂肪类、蛋白类和无机元素类等物质在一定条件下发生生物化学反应并对其产生的物理性质上的改变做出定量检测,从而测定生物化学以及机体功能指标的一种诊断方法。其原理是通过使用生化诊断试剂和生化分析仪,当相关待测物与试剂出现特异反应时,由生化仪对特异反应产生的光学信号进行记录并与校准品对比从而判定相关待测物的水平。生化诊断的干化学技术广泛应用于临床急诊的生化项目检测和其他的血常规、尿常规、肝功能、肾功能检测。生化诊断技术趋于成熟,全球生化诊断市场发展稳定。生化诊断市场规模保持稳定增长,是全球体外诊断市场发展最为成熟的细分领域之一。根据Kalorama Information预测,2022年的全球生化诊断市场份额相比2019年增长了11.8%,市场销售额将在2022-2027年间从97亿美元增长到104亿美元。随着分子诊断以及免疫诊断等细分领域的蓬勃发展,生化诊断的IVD市场占比存在下滑趋势,预计2027年生化诊断占比将降至7.4%。国内生化诊断市场保持稳定增长,生化试剂发展成熟。生化诊断在我国经历了30余年的发展,已经成为我国体外诊断行业中发展最为成熟的细分领域。根据《中国医疗器械蓝皮书》,生化诊断占我国IVD市场的比例达到19%,仅次于免疫诊断。中国生化诊断市场规模稳定增长,预计2023年将超过270亿元。我国大部分的生化诊断企业集中在试剂领域,并且我国市场上70%以上的试剂为开放试剂,可以适配不同厂商生产的生化仪器。国产生化分析仪器厂商数量相对较少,经历了从手动生化分析仪朝半自动化到自动化生化分析仪再到模块化方向的发展历程。生化市场打破外资垄断,试剂国产化率高。中商产业研究院的数据显示,2019年中国生化诊断约35%的市场份额仍由外国厂商贝克曼库尔特(丹纳赫)、罗氏、强生、西门子占据,而国内规模较大的生化诊断厂商如迈瑞医疗、美康医疗、九强生物等也占据了市场大约三分之一的市场份额。目前我国70%的生化试剂市场份额已经被国内厂商占据,国产化率高,高性价比的优势将助力国内生化试剂从低端市场逐步进军中高端市场实现国产替代。而国内生化诊断仪器研发起步相对较晚,高端市场仍主要是外资玩家,中下游市场竞争将会随国外仪器产品的下沉变得更加激烈。国内生化分析仪发展势头良好,逐步进军高端市场。生化分析仪主要用于向各级医院提供多方面项目及不同生物指标的检验。国内生化分析仪器产业起步相对较晚,但经过三十余年的自主研发,许多国产生化诊断企业已经能够生产出与外资厂商竞争的生化分析仪,在中低端市场份额实现快速增长,但在高端市场市占率仍较小。根据2023年第一季度的生化分析仪品牌中标情况,迈瑞医疗、科华生物、迪瑞医疗等国内生化仪器龙头位居前列,其中迈瑞医疗在中标总额和数量份额上都远超日立高新、贝克曼、罗氏等国外厂商,表现亮眼。未来国产生化仪器厂商有望通过政策利好和价格优势提升国内生化分析仪市场的国产化率,逐步进军高端市场。迈瑞引领生化仪器发展,重点布局中高端市场。在生化领域,迈瑞注重产品研发推广,积极参与国内医疗新基建并大量进军海外高端客户群,提高市场渗透率与知名度,是生化细分领域的龙头企业。以23Q1生化分析仪中标总额前十的产品为例,国产生化分析仪的中标总额占比约为30%。其中迈瑞在中标前十的产品中占了3种,中标总额占比约为20%,超越日立高新和贝克曼等国际品牌。2022年,迈瑞大量布局新上市的BS-2800M全自动生化分析仪,积极升级迭代已上市的M1000全自动生化免疫流水线和BS-600M全自动生化分析仪。BS-600M凭借优异性能助力突破国际中端市场,增加市占率;M1000帮助迈瑞确立在级联流水线的领导地位,对于突破中高端市场具有战略意义。未来迈瑞将通过在自动化流水线、检验室智能化等方面的产品研发和平台完善扩大在生化仪器市场的领先优势,巩固市场龙头地位。生化试剂完成国产替代,国产品牌各自深耕细分领域。生化试剂发展起步较早,目前国产厂商已经基本实现生化试剂的国产替代,国产品牌已占据了大部分的国内生化试剂市场份额,覆盖全层次等级终端市场。但目前国内生化试剂市场结构仍较为松散,集中度较低,同质化问题严重。在这样的背景下,一些国内较有代表性的厂商选择深耕擅长的细分项目,创新研发新产品、布局新领域,走差异化发展线路。比如九强生物的生化试剂主要集中在肝功能、血脂类、肿瘤标志物类,试剂数量分别为20、18、13项;而迪瑞医疗则擅长肝功能和心血管疾病类的试剂产品。03POCT:优势独特,增长迅速POCT,又称即时检验(point-of-care testing),是指在采样现场进行快速得到检验结果的一类诊断方法。POCT由于对场地、仪器、操作人员、样本处理要求低,具有便捷、快速、低成本等独特优势,和实验室高端、精细化、高度集成化检测代表了临床应用的两种不同需求,两者相辅相成,相互补充。国内POCT起步时间晚,处于快速发展阶段。POCT是体外诊断中增速最快的细分领域之一。2015年全球POCT市场规模为215亿美元,2022年增长至405亿美元,年均复合增长率为8.23%。中国POCT由于起步较晚,市场规模较小,终端渗透率较低,目前仍处于快速发展阶段。国内POCT市场规模从2015年的43亿元快速增长至2019年的112亿元,CAGR高达21.10%,预计到2024年市场规模达到290亿元,2019-2024E年均复合增长率保持在15.68%,发展势头强劲。全球市场国际巨头垄断,中国市场相对分散。全球市场主要由国外巨头垄断,CR6占据约70%的市场。国外品牌由于进入POCT赛道时间长、技术积累、品牌效应等优势,在中国市场占据主导地位,罗氏、强生、雅培共占45%的市场份额;国内企业因新冠疫情助力近年增长数量较多,呈现“小而散”的状态。其中,份额较大的企业是万孚,三诺和基蛋,分别占据9%,7%,7%的份额。POCT持续迭代更新,分子诊断结合POCT成为未来主流。POCT技术平台不断更迭,经历了定性检测到半定量到全定量检测,从干化学、免疫层析、化学发光到生物传感器、生物芯片、微流控技术,POCT进入了自动化信息化智能化时代。分子诊断的快速普及将带动应用分子诊断方法的POCT即分子POCT的发展,其既具备POCT快速便捷的特点,又融合分子诊断灵敏度高、准确度高的优势,将成为体外诊断未来发展的主流方向之一。POCT应用场景丰富,渗透率上升空间广阔。从应用环境来看,POCT检测既适合医院和急诊,也适合个人健康管理和重大疫情检测等。从应用场景来看,POCT适用于医院的病房、门诊、急诊、检验科、手术室、监护室等科室,也适用于体检中心、实验室检测,或进行家庭自检,应用场景丰富。2019全球POCT渗透率为45%,中国仅为16%;渗透率水平较低,上升空间较大。随着经济不断发展、民众健康意识增强,“预防为主,防治结合”的医疗理念逐渐深入人心,个性化诊疗不断推进,POCT将会被运用到更多场景,渗透率也将随之提升。POCT覆盖疾病领域广泛,血糖类检测发展成熟。POCT可检测的领域随着技术发展不断增多,目前包括心血管疾病、感染性疾病、内分泌疾病、儿科疾病、血液相关疾病、肿瘤、妊娠类多个领域。在全球POCT市场中,占比最大是血糖类产品,到达近30%,是目前发展最成熟,渗透率最高的POCT细分种类之一;其次是血气类和心血管类产品;在中国市场中,除了血糖类、血气类和心血管类,感染类POCT产品也占据较大市场份额。万孚生物产线完整,其它公司各有特色品类。国产企业中万孚生物创立时间较长,覆盖的疾病范围最广,其中传染病类是公司特色产品;基蛋生物和明德生物覆盖数量较多,分别在心血管类和血气类具备特色。在国内企业中,万孚在POCT非血糖类市占率最大,拥有时间、技术和资金优势,持续进行大量研发投入,产品品种覆盖多种疾病;作为最早进入POCT心血管领域的国内企业,基蛋生物的心血管类和炎症是其主要试剂收入来源;东方生物和三诺生物分别在毒检和糖尿病类各具优势。一系列利好政策释放POCT增长空间。分级诊疗政策的推进将需要康复治疗的患者、慢病患者转诊到二级医院或基层医疗机构, POCT凭借方便、快速、不依赖医师和大型设备等优势适用于基层医疗机构,将成为患者定期检查与慢病管理的重要方式。“五大中心”的建设也将推动POCT市场向前发展,POCT设备重复出现在胸痛中心、卒中中心、妇幼中心的建设产品名单中,极大地满足了急危重症领域的临床需求;截止2022年9月,“五大中心”已建成超1.4万个,其中卒中中心新建2000多家,胸痛中心新建5000多家,提升POCT增长天花板,市场有望持续扩容。04分子诊断:疫情助力市场快速扩张分子诊断是指应用分子生物学方法检测患者体内遗传物质的结构或表达水平的变化而做出诊断的技术。具体而言,通过分析DNA、RNA或蛋白质的表达,通过寻找遗传密码中的异常或变异,或确定特定基因的存在,以确定疾病的易感性或存在性,并将这些信息提供给医疗服务提供者,以进行风险评估、诊断、预后和治疗。根据检测原理,分子检测可以分为PCR、原位杂交、基因芯片、基因测序四大类。疫情助力全球分子市场快速发展。疫情前,全球分子诊断处于稳定增长的状态,2013-2019年的年均复合增长率为10.41%,六年时间市场规模翻了一倍。疫情推动全球分子诊断市场规模迅速发展,从2019年的114亿美元增长到2022年的213亿美元,年均复合增长率为16.91%。其中2022年全球市场规模中有111亿美元来自新冠相关检测,超越102亿美元的常规项目检测。我国分子诊断市场由于起步晚,市场规模较小,处于快速发展初期。2015-2019年CAGR为22.06%,远高于体外诊断平均增速。新冠疫情将分子诊断推向新的高峰,市场规模迅速扩大至2020年的226亿元,虽2021年有所回落但高速增长的趋势不会改变。新冠疫情加速行业发展,推动产业链完善。新冠疫情带来的大规模核酸检测需求催生了高通量、自动化的分子检测仪器,加速分子检测自动化进程,促进企业完善分子产品布局。随着新冠大规模筛查的普及,国家要求二级以上医院配备PCR实验室,很多县级医院和乡镇医院都建设了标准的PCR实验室,PCR上岗证持证人数也快速增加;后疫情时代,大量闲置的PCR实验室、仪器和人员促进分子检测价格下降,为行业快速发展奠定坚实基础。此外,新冠疫情推动产业链上游试剂原料国产化率提升,拓宽下游应用场景,为中游的分子诊断厂家提供爆发式增长的发展机会以及充裕的现金流,使分子诊断行业发展提前了5-10年。政策利好推动发展,肿瘤诊治领域大有可为。分子诊断凭借精准、快速、简便等优点得到快速发展,疫情推动分子诊断进一步发展,特别是传染病领域,PCR法是检验的“金标准”,国内PCR实验室下沉将带动分子检测打开更大空间。由于医疗保健意识增强和医保覆盖面扩大,人们对传染病、肿瘤、遗传病的筛查更加关注,分子诊断也被更多使用。2022年1月,卫健委发布的《“十四五”卫生健康标准化工作规划》提出要坚持预防为主,利用检验诊断方式预防传染病、寄生虫病、地方病等,分子诊断在传染病筛查占据重要位置。我国是癌症高发国,肿瘤的早发现早治疗会患者意义重大,卫健委发布的《肿瘤诊疗质量提升行动计划》提出要制定安全、有效、经济的肿瘤筛查方法,推动分子诊断在肿瘤领域的应用。分子诊断覆盖领域广泛,PCR技术应用最为成熟。分子诊断的主要应用方向是传染性疾病检测、肿瘤个体化诊疗、血液筛查、产前筛查、遗传性疾病筛查、药物代谢基因组学等领域,应用领域广泛。应用最广泛的分子诊断集中在感染性疾病的快速、准确诊断,细菌或病毒感染性疾病检测是分子诊断最常见的项目。在分子诊断技术中,PCR技术应用成熟且临床使用广泛,占据分子诊断市场40%份额。通过疫情的推广,PCR方法进一步得到扩张和普及,实验室数量也有了爆发式增长。全球市场格局分散,疫情推动国产品牌份额增加。在全球市场中,分子诊断市场比较分散,CR5仅占据36%的市场份额,罗氏、赛沛(丹纳赫)、豪洛捷位列前三,国内企业华大基因占据3%的份额。在中国市场中,新冠核酸试剂的大规模销售带动国产企业达安基因、华大基因、科华生物市场占比快速上升,超越国际品牌位列前三;常规试剂方面,雅培、罗氏仍主导国内市场份额。核酸提取仪国产化率高,性能优越。分子诊断常见仪器有核酸提取仪、实时荧光PCR仪、基因测序仪、质谱仪等,其中核酸提取仪国产率最高。国内企业经过技术积累创新纷纷推出自产的核酸提取仪,包括达安基因、圣湘生物、之江生物、天隆科技、硕世生物等公司。根据公司官网数据,检测样本数量最多的仪器是天隆科技的Npex 192和GeneFlex 192,达到192个样本数量;检测速度快速的仪器为之江生物的EX3600和天隆科技的GeneMix Pro,不到20分钟可处理96个样本;处理体积方面,达安基因的DA3500能够处理2000uL最大量体积。国内企业是中国试剂市场主要参与者,产线重合导致竞争激烈。在国内分子诊断试剂市场竞争中,受制于产品价格及注册成本高昂等因素,跨国企业参与者较少,国内企业成为试剂市场主要参与者。传染病领域试剂产品受益于新冠疫情助力而蓬勃发展,占据较大市场份额。在分子诊断应用领域,各家公司产品线有重合部分,在HPV、性传播、优生优育、呼吸道感染方面竞争激烈。各家公司近些年不断扩充试剂菜单,覆盖更多病种,其中凯普生物覆盖的领域较多,并且在HPV市场占据一定市场份额;透景生物和硕世生物则在部分领域深耕。05凝血诊断:市场参与玩家少、国产替代空间大血栓与止血(简称凝血)体外诊断主要包括凝血检测、血流变检测、血小板功能检测等,主要应用于各种血栓性及出血性疾病的预防、筛查、诊断和监测。《中国心血管健康与疾病报告2021》报告推算心血管病现患人数3.3亿,2019年农村、城市心血管疾病分别占死因的46.74%和44.26%,平均每5例死亡中就有2例死于心血管病,心血管病死亡率居于首位。凝血诊断可以帮助医生有效分析血栓和出血原因,对包括心脑血管疾病在内的血栓性疾病以及出血性疾病等进行预防、筛查、诊断和监测。血栓疾病认知持续深化,推动凝血检测发展。国内外研究数据表明,40%-60%的住院患者存在静脉血栓栓塞症(VTE)的风险,而高危人群的预防比例很低,早期识别高危静脉血栓栓塞患者并及时预防,可以减少医院内的发生静脉血栓栓塞。近年来内科、骨科、血管外科、呼吸科、肿瘤科等各学科协会相继发布了各种血栓性疾病防治相关的指南和专家共识,促进了临床医生对血栓性疾病相关诊断项目的认知,也促进了凝血主流检测项目在国内的发展。中国心血管疾病高发,凝血市场处于快速发展期。由于老龄化加剧、心血管疾病患者和慢性病患者逐渐增多,凝血诊断需求随之增长,2015-2020年间的全球凝血市场规模复合增长率为8.6%,快于体外诊断市场平均发展速度。我国作为心血管疾病高发国家,心血管疾病患者基数大,凝血检测需求高企,凝血市场规模从2016年的35亿元增长到2020年的75亿元,期间复合增长率达到16.47%,处于高速发展阶段。随着人口老龄化加剧导致的心脑血管疾病、慢性病发病率提升、医疗资源的下沉、血栓与止血诊断技术的进步,国内血栓与止血诊断市场有望进一步扩容。主流检测项目充分竞争,特殊检测项目玩家较少。过去很长时间,凝血项目主要是PT、APTT、TT、FIB四项,用于凝血功能筛查。随着心脑血管疾病的高发,D-二聚体、FDP、AT检测项目的应用在三级医院得到普及,七个项目在各省都已进入医保目录。主流检验产品由于行业内厂家基本都生产销售相应试剂产品,市场处于充分竞争状态。特殊检测项目国内开展率和检测量相对较少,试剂销售量也较少,仍处于逐步推广和普及阶段,目前主要由西门子、思塔高、美国国家仪器实验室等外资厂家提供产品。凝血检测呈现出向疾病预防、疾病诊断和药物治疗监测发展的趋势,预计特殊检测项目对应的试剂销售规模也将逐步上升。分级诊疗促进技术下沉,打开凝血市场空间。目前凝血检验主要集中在三级医院,基层医院由于基础设备缺失和医疗水平不足开展凝血检测数量较少。随着分级诊疗的推行,分流至二级医院及以下医疗机构就诊的血栓性疾病、出血性疾病的患者数量将会增加,相应血栓与止血诊断技术向二级医院及以下医疗机构下沉,从而有效提高凝血检测需求与检测量,结合学术教育和应用技术支持,未来增长潜力大。国外企业占据第一梯队,国内企业有望实现层级突破。在国内凝血检测市场,公司按照市场份额可以分为三大梯队,第一梯队为国外品牌:希森美康、思塔高和沃芬,主导国内市场份额;第二梯队为有一定份额的国内企业:赛科希德、上海太阳、迈瑞、众驰伟业;第三梯队为国内其他规模较小企业。相比于国际品牌,我国企业发展凝血诊断时间晚,覆盖的诊断种类不够全面,仍处于研发积累阶段。随着分级诊疗带来的医疗资源下沉和国产企业技术的不断创新,国产企业有望突破进入第一梯队,实现国产替代。高端机型性能差距进一步缩小,联检速度实现超越。在单项目测试速度上,沃芬的ACL TOP700达到最高720PT/h,国产品牌众驰伟业的XL3690能够达到600PT/h,靠近国际顶尖水平;迈瑞、赛科希德测试速度达到450PT/h,比肩希森美康。在联检速度上,迈瑞的CX-9000达到450/h,赛科希德的SF-9200达到330/h,超越沃芬和思塔高的240/h。总体来说,国内品牌高端仪器在技术上拥有较强竞争能力,能够满足三级医院的检测速度要求,有望进一步扩大高端市场销售份额。主流项目覆盖全面,特殊项目有待布局。国外企业凭借进入凝血领域时间长、技术累计丰富等优势,在开展特殊检测项目研发方面发展较快。目前国内企业生产销售以主流检测项目为主,特殊检测项目产品较少。作为凝血国产龙头,赛科希德深耕凝血领域产品研发,拥有完备的特殊检测项目试剂菜单,包括狼疮抗凝物、抗凝血酶等项目,比肩国际巨头,市场优势明显。目前国产企业已陆续开始布局特殊检测项目的研发注册,未来市场规模将逐步增加。06微生物检测:技术壁垒高,发展空间广微生物检测是通过微生物的培养、鉴定、分析以及药物敏感测试等方式检测微生物的品种和浓度,为疾病的预防、诊断、治疗和疗效观察提供依据。微生物检测平台主要有四种方法,传统技术、血清学与免疫检测、基因检测、质谱。其中传统技术和免疫检测发展较为成熟,基因检测和质谱是新型技术,基因检测将敏感性、特异性、准确性进一步提高,质谱技术大大缩短检测时间。全球市场稳步扩张,新兴市场为强增长点。技术进步、感染性疾病发病率提升、新冠疫情的爆发等因素促进了全球微生物市场的扩大,全球临床微生物市场规模预计从2020年的3.9亿万美元增长到2025年的5.3亿美元,期间年均复合增长率为5.2%。目前,全球微生物市场大部分市场位于发达国家,北美占比为45%,欧洲为35%。亚太地区占比为16%,其他地区为4%,预计未来亚太和其他地区会有较大增长,为全球微生物市场注入强劲的发展动力。控制管理抗生素滥用推动国内微生物诊断发展。我国是抗生素使用大国,抗生素使用量每年较快增长。抗生素的滥用会导致病原微生物产生耐药性、降低药物疗效。2016年8月国家14个部门联合制定、出台《遏制细菌耐药国家行动计划(2016-2020年)》,从国家层面、多个领域打出组合拳,以应对细菌耐药带来的挑战,提高抗菌药物科学管理水平,遏制细菌耐药发展与蔓延。微生物检测可以确定病原微生物的种类,有效控制抗生素滥用,指导医生精准用药,减少药物的使用量、提高诊断和治疗效果。中国微生物检测市场规模预计2023年达到90.2亿元,2019E-2023E年均复合增长率为7,7%,保持稳定增长。技术创新拓宽应用场景,感染病高发创造市场空间。技术升级克服检测范围的局限,创造新的应用场景。PCR、质谱、NGS等新型技术降低了传统方法的复杂程度和局限性,驱动微生物检测行业持续发展。例如质谱技术方法突破了传统技术菌落培养的过程,直接上机检测,极大的压缩检测时间并且提高鉴定的准确性。同时,微生物检测是查明感染病原微生物的有效方法,进而实施精准治疗、控制感染病发展蔓延。我国感染性疾病的发病率和死亡率维持在高水平,为微生物检测创造市场空间。国外品牌占据主导,国产品牌不断崛起。在微生物诊断领域,由于国外品牌开始时间早、技术积累丰富、品牌影响力大,在国际市场占据主导地位,也占据国内大部分市场。我国微生物诊断行业起步比较晚,发展缓慢,在仪器和试剂研发生产方面竞争力较弱,需要依赖国外厂商供给。微生物诊断不同技术领域有不同的代表厂家,在相对成熟的传统技术和免疫检测领域,外资龙头和国内大型企业主导市场,传统技术代表企业有生物梅里埃、BD、安图生物、鑫科生物等,免疫领域主要企业为科华生物、安图生物。在质谱技术领域,国外代表企业有布鲁克(BD合作代理)、生物梅里埃(与岛津合作,岛津提供仪器技术,梅里埃提供微生物菌种库),国内代表企业有毅新博创、安图生物、珠海迪尔等。在分子诊断技术领域,代表企业有华大生物、江西普瑞森、美国Ubiome。质谱仪器市场仍是进口厂商为主,生物梅里埃和布鲁克占据主要地位。多个国内厂家如安图生物、融智生物等已推出质谱仪器,进入质谱仪器市场。目前国产微生物质谱仪器仍处于起步阶段,机器各项性能需要不断完善与优化,通过提高装机量进一步扩大市场份额,国产替代之路任重而道远。07相关公司迈瑞医疗:全球市场医械龙头,国内集采最大赢家三大产线四大种子业务,全球化布局提升协同能力。迈瑞医疗成立于1991年,主要从事医疗器械的研发、制造、营销和服务,致力于为全球医疗机构提供优质产品和服务。迈瑞深耕医疗器械领域,通过内生增长和外延并购并重的发展道路,形成三大主要业务板块和四大种子业务。其中,三大主要业务板块包括生命信息与支持、体外诊断(IVD)和医学影像,四大种子业务为动物医疗、AED、微创外科和骨科耗材。迈瑞目前在全球设有50多家境外子公司,服务190多个国家和地区,在欧洲、西雅图、硅谷、新泽西设有研发中心。迈瑞的产品和服务进入国内99%的三甲医院,660多家欧洲教学医院,美国排名前20的医院均为迈瑞客户。覆盖IVD多个领域,营收保持稳定增长。迈瑞的体外诊断产品包括免疫诊断、生化诊断、凝血、微生物、血液细胞学检测、尿液检测等检测,布局多条体外诊断产线。在仪器端,迈瑞每条产线均推出多款仪器,实现仪器端的全覆盖。在试剂端,迈瑞的生化试剂涵盖肝功能、肾功能、心肌标志物、糖尿病等10个种类,化学发光试剂涵盖肿瘤标志物、甲状腺功能、传染病、性激素等10个种类。从试剂原材料端,迈瑞2021年收购了全球知名IVD原材料公司海肽(HyTest)生物,实现了IVD原材料领域核心技术的自主可控。从营业收入来看,迈瑞近五年实现体外诊断业务的快速稳定增长,从2018年的46.26亿元增长到2022年的102.56亿元,实现营收翻番,2018-2022年的CAGR为17.26%。其中2022年的化学发光收入增长近30%。随着迈瑞加大仪器和流水线的装机、加速渗透海外中大样本量客户、以及国内常规业务的恢复,未来试剂放量将带来体外诊断收入的快速增长。发光仪器比肩国际品牌,集采助力市场份额扩大。仪器检测速度方面,化学发光仪器CL-8000i能够达到500T/h,超越国际品牌产品的检测速度。仪器性能方面,迈瑞持续优化分析仪设计,CL-8000i采用涡旋+超声波混匀技术,提高对纤维蛋白原样本的抗干扰能力,硬件参数接近国际一线水平。试剂方面,不断扩大菜单品种,提供更丰富试剂类型;迈瑞收购海肽生物,实现原料的自主可控。迈瑞通过安徽化学发光集采成功扩大市场份额,2022年迈瑞在安徽省的化学发光业务实现超过85%的增长,试剂收入增量超1亿元,成功突破空白三级医院35家,市占率提升至20%以上,成为安徽市场第一。在福建省宁德市和南平市的集采中,迈瑞IVD全线中标,预计带来化学发光试剂较大增量。随着集采的落地和推进,迈瑞凭借其市场与品牌优势将获得更多市场份额。生化诊断产线完备,剑指高端市场。在生化仪器类型上,迈瑞推出全自动化生化分析仪产品、模块化生化检测系统、生化免疫分析流水线。其中模块化生化检测系统的BS-2800M具有一触立检功能,能够实现任意状态下1分钟启动检测,单模块测试速度达到2400T/H,成为国内顶尖7大生化分析仪之一。在江西省牵头的生化肝功能集采中,迈瑞报量前后在当地市场占有率提升一倍左右,中标结果按毫升量排名位列第一,表现突出。集采中标优势结合产品的高知名度与认可度推动扩大三级医院市场份额,实现高端替代。新产业生物:国内市场装机表现亮眼,海外市场释放增长空间布局四大产线,专注化学发光。新产业成立于1995年,主要从事体外诊断领域产品的研发、生产销售及客户服务。自成立以来,一直专注于化学发光免疫分析领域的研究,从事研发、生产及销售系列全自动化学发光免疫分析仪器及配套试剂,是国内化学发光领域的领先者。公司建立了纳米磁性微球研发、试剂关键原料研发、全自动诊断仪器研发及诊断试剂研发四大技术平台,先后研发出中国第一台全自动化学发光仪及配套试剂、超高速全自动化学发光免疫分析系统MAGLUMI X8等,打破跨国公司长期技术封锁和产品垄断。营收和归母净利润亮眼,高端市场持续布局渗透。新产业营业收入从2018年的13.84亿元增长到2022年的30.47亿元,年均复合增速达到22%,实现快速增长;归母净利润从2018年的6.94亿元增长到2022年的13.28亿元,CAGR为17.6%。2022年高端机X8全球累计销售/装机达到1842台,同比增长69.61%,高端机占比不断提升。2022年新产业三级医院客户数量新增171家,三级医院的高检查量将快速带动试剂收入和单机产出,延续“仪器带动试剂,试剂促进仪器销售”的良性增长循环。装机数量表现亮眼,助力拓展终端客户。新产业注重发光仪器销售,积极推进装机进院,仪器营收占比逐年增加。截止2022年底,新产业化学发光免疫分析仪器国内累计装机超11300台;在海外已为151个国家和地区的医疗终端提供服务,累计实现化学发光免疫分析仪器销售超15100台。受益于积极的销售政策,新产业的终端客户数量持续突破。截至2022年底,新产业为国内近8700家医疗机构提供服务,其中三级医院客户达到1380家,国内三甲医院的覆盖率达55.66%,海外市场蓬勃发展,海内外双轮驱动营收增长。新产业重视海外市场建设,2022年公司在俄罗斯、巴西、墨西哥、巴基斯坦、秘鲁完成设立总计 5 家海外子公司,实施本地化经营,推动海外重点国家的开拓市场和服务终端的能力。近年海外营业收入不断增加,海外收入占比也从2017年的19.69%提升至2022年的31.84%,即使受到疫情影响海外营收仍逆势增长。海外市场空间广阔,有望为公司打开第二增长曲线,取得海外的市场先发优势与品牌优势,为公司贡献收入。发光仪器性能优越,发光试剂种类齐全。2019年新产业推出了全球最高速MAGLUMI X8高速机,速度高达600测试/小时,拓展后速度可达2400测试/小时,取得行业跨越式突破进展。并与MAGLUMI X6/X3共同形成全自动化学发光免疫分析超高速、高速、中速全布局,覆盖全层次医疗终端。截至2022年底,新产业面向全球销售10款全自动化学发光免疫分析仪器及193项配套试剂,其中取得欧盟准入的化学发光试剂186项,是国内提供化学发光免疫诊断试剂种类最多的供应商之一。 多产线布局成效显著,公司综合实力增强。在生化诊断产品线上,新产业积极拓展,面向全球销售5款全自动生化分析仪器及61项配套试剂,其中国内已获注册的生化试剂61项,配套试剂涵盖肾功能、肝功能、特种蛋白、脂类等检测项目。在分子诊断方面,部分核酸检测试剂产品获得欧盟准入,2021年推出自动核酸提取纯化仪和核酸提取试剂盒两项产品,2021年下半年完成免疫层析快速检测诊断平台的建设。在凝血诊断方面,2022年6月首个凝血试剂获得NMPA证书,截至2023年4月共有3项目凝血诊断试剂取得注册证书,凝血试剂获批丰富了新产业检测试剂类型,增强公司综合实力。迪瑞医疗:华润入主赋能业务发展,七大产线共同发力驱动增长以尿分起家拓展至七大产线,华润入主赋能销售导向转型。迪瑞从事医疗检验仪器及配套试纸试剂的研发、生产、营销与服务。迪瑞以尿液分析起家,业务逐渐扩展至生化分析、化学发光免疫分析、妇科分泌物分析、血细胞分析、凝血分析、整体化实验室,共有七大系列产线。华润入主后,在华润管理和业务赋能驱动下,实施以销售为核心的战略导向转型,2022年国内新增 200 余家代理商,国际市场代理商新增 50 余家,实现仪器收入同比增长70.11%。产品上新速度快,营收进入增长新阶段。2022年迪瑞完成10余项新产品上市,其中仪器涉及CM-640/640i全自动化学发光免疫分析仪、BCA-4000全自动凝血分析仪等产品;试剂主要涉及完善化学发光免疫分析检测产品。目前化学发光产线覆盖甲状腺功能、传染病、性激素、骨代谢、炎症等多项目检测,可以满足不同规模的终端临床需求。从营业收入来看,由于疫情和子公司股权转让,2020、2021年营收有所下滑,业务整合后迅速恢复快速增长,2022年增速达到34.69%,2023Q1更是攀升至46.54%。从归母净利润来看,2022年和2023Q1均呈现较快增长的趋势,其中2023Q1归母净利润达到0.78亿,比上年同期增长27.8%,正式进入增长新阶段。尿分领域产品丰富,核心技术竞争力强。迪瑞是国内企业在尿分领域起步较早的公司之一,紧跟国际技术创新,产品不断迭代更新。2006年公司推出第一台国内全自动尿液分析仪;2010年推出FUS系列首款产品,获得海外客户的正面反馈;2018年推出高通量的FUS-3000Plus和体积小检测项目全的FUS-1000,实现尿分自动化产品的高中低档全覆盖;2019年迪瑞推出模块化流水线MUS-3600,检测速度可达480测试/小时,进一步提升自动化水平。在核心技术方面,迪瑞积累了尿液分析仪的自动追光技术、基于模糊技术的抗干扰算法,尿有形成分分析仪的自动聚焦技术、平面流式细胞技术等,展现深厚研发功底,筑深技术护城河。多产线布局体外诊断,化学发光产线增长势头良好。生化诊断方面,迪瑞拥有十五年生化领域研发、生产及销售经验,全球累计装机量约20,000台,迪瑞推出从CS-380到CS-2000全系列自动生化分析仪,覆盖中高低端市场。其中在生化诊断试剂方面,迪瑞在江西集采中标结果良好,进一步扩大生化产品在高端市场份额。化学发光方面,2022年推出CM-640全自动化学发光免疫分析仪,灵敏度高,结果准确可靠,最高检测速度可达640测试/小时,拓展最高可达2560测试/小时;化学发光试剂覆盖传染病、肝纤维化、骨代谢、甲状腺等13个板块,试剂菜单较为齐全;化学发光收入持续增加且增速较快,占总营收比例超10%。整体化实验室方面,2022年智能化产品线增长态势实现新的突破,为未来业绩增量提供产品保障。在妇科分泌物分析方面,迪瑞推出三款产品及配套检测试剂。在血细胞分析方面,推出七款产品及配套试剂。微生物目前处于布局当中,分子类产品由投资参股公司致善生物生产。华润销售渠道赋能支撑迪瑞多产线健康发展,共同驱动营收更上一个新台阶。安图生物:发光为基拓宽产线,注重流水线产品布局体外诊断龙头企业,技术创新引领发展。安图生物专注于体外诊断试剂和仪器的研发、制造、整合及服务,产品涵盖免疫、微生物、生化、分子、凝血等检测领域,致力于为医学实验室提供全面的产品解决方案和整体服务。安图将技术创新放在发展战略首位,多年研发投入占比超11%,建立起以郑州为中心,北京、上海、苏州、深圳、北美为分支机构的研发体系。截至2022年底,安图已获专利1154项(包含国际专利51项),包含发明专利124项;获得产品注册(备案)证书651项,取得444项产品的欧盟CE认证。安图市场营销网络覆盖全国30个省级行政区,在全球超80个国家和地区设立销售和维护网点。营收、归母净利润保持稳定增长。安图营业疫情逆势快速增长,盈利能力强。安图收入增长稳定,从2018年的19.30亿元增长到2022年的44.42亿元,在新冠疫情期间仍能保持18%以上的年复合增长率,实现逆势增长,足见其较强的盈利能力与市场韧性。2023Q1因为上年同期的高基数增速出现下降。归母净利润从2018年的5.63亿元增长到2022年的11.67亿元,期间CAGR为19.99%。随着疫情消退带来常规诊疗及终端采购需求的恢复,预计安图收入将保持稳健增长。化学发光产品覆盖全面,流水线助力国产替代。2022年安图推出新一代高通量化学发光免疫分析仪Autolumo A6000系列,进一步丰富化学发光产品线,可满足大、中型医学实验室的检测需求,跻身化学发光仪器高速机行列。2022年安图自主研发、制造的流水线Autolas X-1 Series正式上市,该流水线提升了线体多项关键性能指标,能更好地控制成本,满足中国本土实验室的需求,性能指标接近甚至某些方面超过国际品牌,助力产品进入三级医院实现国产替代。在试剂方面,安图试剂品种涉及传染病、生殖内分泌、甲状腺功能等多个检测方向,试剂种类位于国内企业前列。IVD领域多点开花,综合实力持续增强。在微生物诊断领域,安图拥有135项注册证书,取得71项产品的欧盟CE认证,试剂品种涉及泌尿生殖道疾病、呼吸系统疾病以及细菌分离培养、鉴定和药敏分析等多个检测方向,仪器涵盖全自动微生物质谱检测系统、全自动微生物鉴定药敏分析仪等产品,成为国内在微生物检测领域产品品种较多、成长较快的企业之一。在生化诊断领域,安图拥有189项注册/备案证书,其中118项产品通过欧盟CE认证;产品涵盖肝脏疾病、肾脏疾病、心血管病、肿瘤等12大类别的生化检测。在分子检测领域,安图开发产品菜单涵盖8大系列60余个项目和随机全自动化核酸(RT-PCR)检测系统;目前已获18项注册(备案)证书,取得了46项产品的欧盟CE认证,目前主要为感染性病原体类检测产品。亚辉龙:免疫诊断龙头企业,自免项目优势突出深耕免疫诊断,高等级医院覆盖行业领先。亚辉龙成立于2008年,主营业务为以化学发光免疫分析法为主的体外诊断仪器及配套试剂的研发、生产和销售,及部分非自产医疗器械产品的代理销售业务。目前亚辉龙有化学发光、免疫印迹、免疫荧光和酶联免疫四大体外诊断技术平台,产品涵盖自身免疫、感染免疫、生殖健康、糖尿病、心血管、肿瘤监测、内分泌代谢等业务领域。截至2022年底,亚辉龙主要自有产品覆盖境内终端医疗机构客户超过4400家,三级医院1330家,三级甲等医院1023家,全国三级甲等医院数量覆盖率为61.96%,为行业领先水平。新冠助力营收高速增长,自产产品比例持续提升。亚辉龙营业收入从2018年的7.29亿元增长到2022年的39.81亿元,期间复合增长率为40.43%,其中2022年新冠抗原检测收入的增长贡献最多,2022年营收增速为237.95%。归母净利润从2018年的0.38亿元增长到2022年的10.12亿元,CAGR为92.79%,其中2022年增长率为394.46%。2023Q1由于疫情结束,新冠业务收入大幅下降,导致营收和归母净利润同比增长为负。随着医院常规诊疗恢复,亚辉龙的常规业务将得到增长。近年亚辉龙加大产品研发力度,加强自研自产能力,自产产品比例从2018年的34.07%快速提升至2022年的92.36%,有助于进一步控制成本,降低业务风险。化学发光领军企业,自免项目优势突出。亚辉龙自2013年至今专注于磁微粒吖啶酯化学发光平台的建设,成功研发出完善的磁微粒吖啶酯化学发光平台,成为国内较早实现磁微粒吖啶酯化学发光免疫分析仪及配套试剂产业化的企业。诊断试剂方面,亚辉龙试剂产品涵盖术前八项、甲状腺、肿瘤标记物等质量稳定的常规检测项目,还拥有自身免疫性疾病、生殖健康等优势突出的特色检测项目,其中亚辉龙的试剂菜单中超1/4都是自免领域的试剂,并借助该优势特色项目快速进入高等级医院。诊断仪器方面,公司产品覆盖超高速、高速、中速、低速全层次化学免疫分析仪,同时布局单人份的POCT化学发光仪以及酶联免疫、免疫印迹及免疫荧光层析诊断仪器,发光产线完备。全自动流水线及配套系统方面,公司推出了全开放式流水线以及智能临床实验室软件系统,支持生化、免疫、凝血、血球和糖化血红蛋白5种分析平台,最多同时连接12台分析系统。九强生物:行业合作夯实主业,横向并购拓宽产线拥有深厚技术积累的平台型体外诊断企业。九强生物成立于2001年,2014年在创业板上市,是以生化诊断、血凝检测、血型检测和肿瘤病理检测的研发、生产和销售为主营业务的高成长型企业。自足生化优势领域,拥有多元化体外诊断系列产品,并已布局化学发光、POCT等产品线。九强在全国范围内拥有广阔的销售网络,形成遍及全球的营销和服务网络。营业收入近两年营收保持高位,2022年增速因高基数承压。营业收入在2018-2020年增长相对平稳,2021年受益于新冠抗原试剂盒的大量销售营收出现爆发式增长,增速为88.58%,2018-2022年复合增长率为14.31%。归母净利润2018-2019年平稳增长,2020年因为收购迈新生物和开拓市场使得归母净利润下滑较多,2021年、2022年归母净利润随营业收入增长而随之提高。生化领域产品种类丰富,持续推进与行业龙头合作。九强是我国生化诊断试剂品种最齐全的生产厂商之一。尤其在高端诊断试剂领域。目前生化诊断试剂主要种类有肝功类、肾功类、特种蛋白和糖代谢类等。九强自有品牌“金斯尔”行业认可度高,产品覆盖体外生化诊断试剂的大多数项目,主要包括胱抑素C、同型半胱氨酸、胆汁酸(TBA)等。在生化检测仪器方面,九强与迈瑞合作销售的高端生化仪G92000测速达到2000T/H,能够同时检测67个生化项目,性能优越。九强与外资巨头雅培业务合作密切,截止2023年4月九强在雅培ARCHITECT平台合作项目共42个;2021年在雅培Alinity c平台新增合作项目共32个,后续还将有60余个项目进入Alinity c平台的合作菜单,有助于进一步提升九强品牌知名度。凝血领域产品表现优异,行业并购助力布局肿瘤病理。在血凝仪器方面,九强自主研发的MDC 3500血凝仪已取得际欧盟注册证,销往全球。血凝试剂涵盖多种检测项目,包括凝血功能评估、血栓风险筛查等,试剂精准度高、可靠性好,满足不同场景的临床检测需求。迈新生物深耕病理三十年,试剂产品全面覆盖临床需求,性能达到国际领先水平;成功研发了国内具有完全自主知识产权的全自动免疫组化染色系统,打破了国外技术垄断;中科纳泰深耕肿瘤预防和检测医学领域,专注CTC(循环肿瘤细胞)事业。九强生物通过并购迈新与中科纳泰切入肿瘤病理蓝海市场,顺应国家精准医疗的政策趋势,有望成为业绩强劲增长点。迈克生物:覆盖细分领域数量行业领先,产线齐全专注体外诊断三十载,产品品种数量行业领先。迈克生物成立于1994年,以代理体外诊断产品起家,专注于体外诊断产品的研发、生产、销售和相关服务。公司自主产品涵盖生化、免疫、临检、分子、快检、病理、原材料等多个技术平台,已成为国内体外诊断生产企业中产品品种最为丰富的企业之一。迈克自主产品的用户已经覆盖全国八千余家各级医院,二级和三级医院产品覆盖率分别达到24%和57%,现已与490余家经销商建立合作,产品涉足117个国家和地区。各产品平台不断推陈出新,2022年新增产品54项,累计取得464项产品注册证。2022年营收因产品结构调整和新冠产品价格下滑,自产产品占比加速提升。公司业绩在2018-2021年保持增长趋势,营业收入从2018年的26.85亿元增长到2021年的39.81亿元,期间复合增长率为10.4%;归母净利润从2018年的4.45亿元增长到2021年的9.57亿元,期间复合增长率为21.1%。2022年由于迈克加快代理产品调整和新冠产品收入下降导致营业收入和归母净利润同比下降9.35%和25.99%。从营收结构来看,随着自主产品能力的不断提升,调整业务结构成为迈克重要目标,因自主产品成本优势远高于代理产品,自主产品销售增长和结构提升将驱动业绩增长。目前迈克自主产品保持稳健增长且在销售收入中占比提升较快,在调整完成后有望恢复高速增长态势。化学发光仪器覆盖全面,试剂菜单配备齐全。迈克化学发光仪器覆盖高中低端市场,包括适合三级医院的i 3000,速度达到300测试/小时,双模块可拓展至600测试/小时,高通量的优势能够满足三级医院庞大的测试量;适合二级及以下医院的i 800和i 1000,速度分别为200测试/小时和180测试/小时。迈克免疫试剂种类丰富,覆盖肿瘤标志物、传染性疾病、生殖激素等15类病种。目前进口品牌占据大部分三级医院等大医院份额,国产企业主要通过特色项目进院,进而带动其他试剂项目的销售,其中迈克的特色项目为传染病和甲状腺功能。顺应行业发展趋势,生化产品逐步转向封闭系统。迈克C800全自动生化分析系统的推出标志着迈克进入生化诊断封闭系统领域,C800将仪器、试剂、校准品配套,通过严格的量值溯源体系把检测标准传递到用户实验室,从而使得系统检测结果准确可靠。封闭系统具备高灵敏度、高准确度等优势,有助于保障高毛利试剂的收入,提高单机产出,是生化产品未来的发展趋势。为生化迈克生化试剂覆盖肝功能、特种蛋白、肾功能、脂代谢类等8个病种,生化试剂能够满足医院检验科常见检测需求。截至2022年底,迈克已获得生化诊断产品124项注册证书,随着研发投入不断转化,未来获证速度不断加快。临检产品快速发展。迈克临检产品包括血细胞、凝血、血凝、尿液四种领域,覆盖相关仪器和配套试剂,还推出了血液流水线以及血液工作站等自动化整体解决方案。2021、2022年临检产品收入分别为0.92亿元、1.38亿元,同比增长42.65%、50.14%,呈现快速增长趋势。科美诊断:深耕化学发光赛道,创新发光技术拉动业绩增长专注化学发光赛道,研发创新发光技术。科美诊断成立于2007年,是一家主要从事临床免疫化学发光诊断检测试剂和仪器的研发、生产和销售的高新技术企业。科美诊断产品为基于光激化学发光法的LiCA®系列诊断试剂和基于酶促化学发光法的CC系列诊断试剂及仪器,主要应用于传染病(如乙肝、丙肝、艾滋病、梅毒、甲肝、戊肝等)标志物、肿瘤标志物、甲状腺激素、生殖内分泌激素、心脏标志物及炎症等的检测。截至2022年底,科美诊断及子公司共拥有199项国内医疗器械注册证书,其中LiCA®系列试剂产品注册证70项,CC系列试剂产品注册证58项,其它(主要为生化试剂)产品注册证71项。营收波动增长,利润相对稳定。营业收入起伏中增长,2022年为4.65亿元,由于CC系列产品销量减少所致,LICA系列产品在疫情影响下仍保持增长态势。在2018-2021年中,除2020年受到新冠疫情影响营收出现小幅下滑外,其他年份受益于LiCA系列产品的销售营业收入都保持在10%以上的增长;归母净利润在2018年扭亏为盈后保持相对稳定的水平。从产品结构来看,LiCA系列产品占比不断提升,从2018年的55.5%增长到2022年的87.03%,提升了31.53个百分点,成为公司支柱性产品。光激发光技术优势明确,LiCA®系列性能优越。科美诊断拥有以光激化学发光为方法学的LiCA®仪器和以酶促化学发光为方法学的CC系列产品。光激化学发光是一种利用抗原-抗体间特异性结合形成感光微球与发光微球相互接近的连接结构,进而实现单线态氧的传递,诱导光激发化学发光过程的“免分离”均相免疫分析方法。进而使LiCA系列仪器具备纳米、免洗、光激发等独特优势,创造性地解决了非均相免疫分析方法需要多步骤清洗可能引起的检测误差等问题。其中LiCA®800为高端化学发光仪器,测速最高达到600T/小时,适合检测量大的三级医院;LiCA® AT 5000速度为500T/小时,最多支持四个模块联机,可扩展到2000T/小时,目前处于开发阶段。试剂种类丰富。科美诊断化学发光检测试剂涉及传染病、肿瘤标志物、甲状腺激素、生殖内分泌激素、心脏标志物及炎症等领域,基本覆盖了国内化学发光检测临床使用量较大的主要检测项目。生化诊断试剂覆盖肝功能、血脂、肾功能、糖代谢、心肌酶、胰腺、特种蛋白、离子等领域,种类较为丰富。以上为科普文章,不具有时效性。END免责声明:本文仅作知识交流与分享及科普目的,不涉及商业宣传,不作为相关医疗指导或用药建议。文章如有侵权请联系删除。TDS2025检测自动化、智慧化实验室建设与应用论坛,合作咨询:李欣欣177 0186 0390。点击图片查看TDS2024会后报告
诊断试剂
分析
对领域进行一次全面的分析。
登录
或
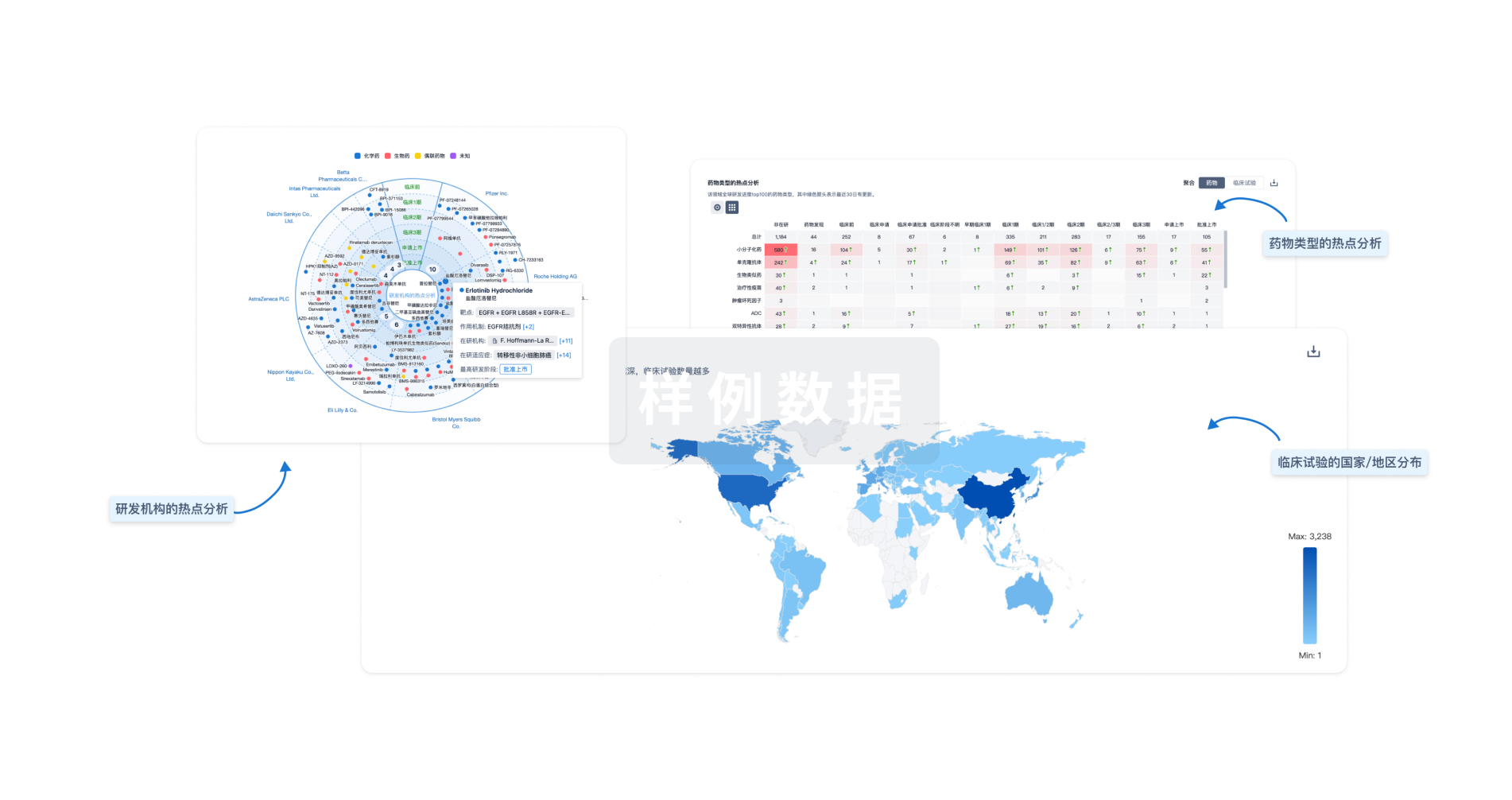
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用



