预约演示
超越AlphaFold2? 新一代AI设计抗癌疗法挺进临床开发
临床申请
人工智能(AI)模型AlphaFold的问世变革了蛋白质三维结构预测和蛋白设计领域。利用AI模型赋能创新药物的发现和开发也已经成为生物医药领域的热点。今日,Iambic Therapeutics公司宣布,利用该公司独有的生成式AI平台NeuralPLexer预测蛋白质/配体复合体三维结构,以及加入药物分子对这些复合体构象影响的研究在Nature Machine Intelligence上发表。新闻稿指出,NeuralPLexer在多项指标的表现优于其它前沿AI模型,包括AlphaFold2。

Preview
来源: 药明康德
蛋白质与小分子配体结合生成的复合体对生命来说至关重要。NeuralPLexer平台的目标是只基于蛋白质的氨基酸序列和配体分子结构,直接预测蛋白质/配体复合体的结构。这一计算平台利用深度生成式AI模型,在原子分辨率的层面对复合体的三维结构以及构象变化进行采样和分析,并且在算法中加入了重要的生物物理学限制。
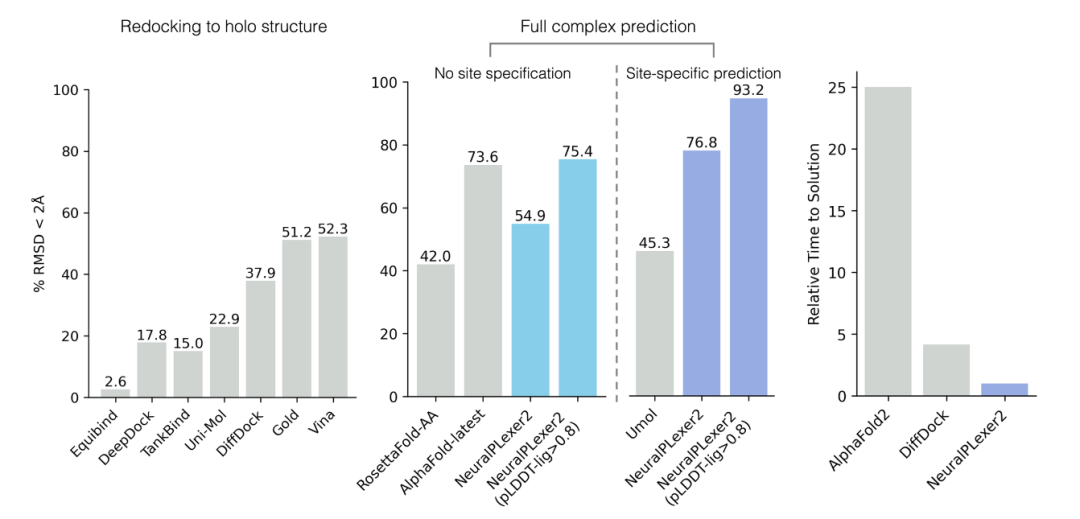
在这项研究中,NeuralPLexer与其它已有模型相比,在预测蛋白质/配体盲对接(protein-ligand blind docking)和预测灵活结合位点结构方面均表现优异。在预测包含大规模构象变化的蛋白质/配体复合体或最新发现的配体结合蛋白的整体结构方面,NeuralPLexer与AlphaFold2相比表现更优。
该公司在2023年10月训练的NeuralPLexer2模型对已有的方法论进行了大幅度改良。除了改进对创新靶点的预测精确度,研究团队还显著扩展了这一模型的应用范围,包括几乎所有生物结构类别,添加了蛋白/蛋白复合体,辅因子(cofactors),翻译后修饰和蛋白质/核酸复合体,并涵盖了蛋白质数据库(PDB)中的几乎所有结构。
在预测表现上,NeuralPLexer2预测蛋白质/配体复合体结构的成功率达到75%,而当给模型提供小分子配体附近的氨基酸信息后,成功率可提高到93%。
Preview
来源: 药明康德
值得一提的是,NeuralPLexer2的结构预测速度也大幅度提高。Iambic发表的白皮书指出,NeuralPLexer2与AlphaFold2相比预测速度提高50倍!提供了进行超大规模的虚拟筛选和在蛋白组范围内研究配体结合诱发构象变化的机会。
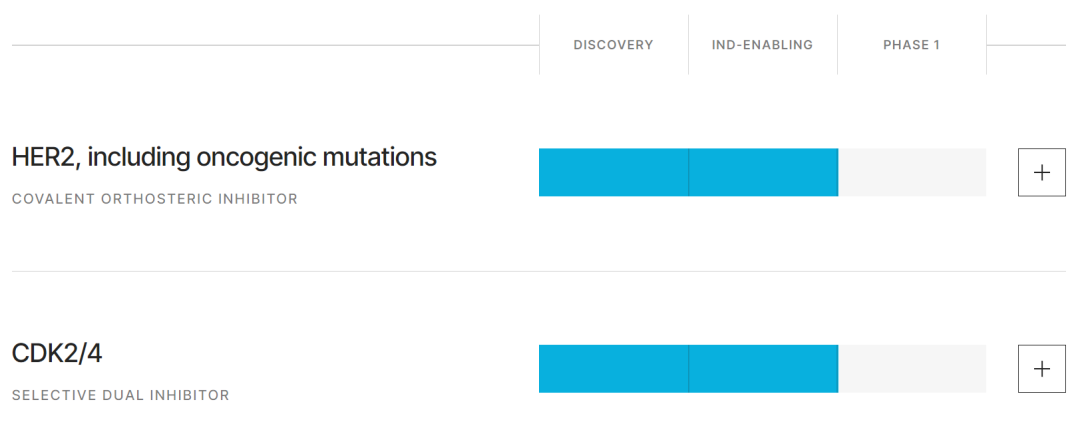
Iambic公司已经将这一系统成功用于创新药物的发现和开发。该公司的主打在研药物IAM1363就是由这一技术平台发现。它是一款选择性,大脑渗透性HER2小分子抑制剂,可以在抑制野生型和致癌HER2突变蛋白的同时,避免对表皮生长因子受体(EGFR)的脱靶抑制效应,从而提高药物的安全性、扩展治疗窗口。在临床前研究中,IAM1363对HER2的选择性是EGFR的1000倍以上。IAM1363的IND申请已经获得美国FDA的许可,预计在2024年初进入临床开发阶段。值得一提的是,这一研发项目从启动到临床试验只用了不到两年的时间。
Preview
来源: 药明康德
在预测蛋白质三维结构上获得突破之后,AI模型正越来越多地被用于创新药物的发现和开发。大型药企也纷纷在这一领域布局。今年年初,礼来公司和诺华公司与Isomorphic Labs公司达成约30亿美元的研发合作,利用新一代AlphaFold技术,针对多个靶点开发小分子疗法。由蛋白设计先驱,华盛顿大学的David Baker教授联合创建的CHARM Therapeutics公司在去年也与百时美施贵宝达成研发合作,利用其名为DragonFold的蛋白质/配体共折叠模型,开发创新小分子化合物。
CHARM公司首席执行官Laksh Aithani先生在接受药明康德内容团队采访时表示,计算机模拟的策略不受治疗领域的限制,可用于任何与蛋白质相关的治疗领域。在改良已有药物之外,AI模型有望找到与蛋白质别构口袋结合的分子,从而靶向没有天然结合位点的蛋白质。他期待在未来五年里,使用计算机模拟方法,不但找到与传统难以成药的靶点结合的小分子,还能使用这些分子对靶点功能进行调节。这对这一领域来说将是一个巨大的进步。
参考资料:
[1] Iambic Therapeutics Announces New Research Published in Nature Machine Intelligence Demonstrating the Capabilities of its Generative AI NeuralPLexer Technology to Predict Protein-Ligand Complex Structures. Retrieved February 12, 2024, from https://www.iambic.ai/post/iambic-therapeutics-announces-new-research-published-in-nature-machine-intelligence-demonstrating-the-capabilities-of-its-generative-ai-neuralplexer-technology-to-predict-protein-ligand-complex-structures
[2] Transforming Computational Drug Discovery with NeuralPLexer2. Retrieved February 12, 2024, from https://www.iambic.ai/post/transforming-computational-drug-discovery-with-neuralplexer2[3] Qiao et al., (2024). State-specific protein–ligand complex structure prediction with a multiscale deep generative model. Nature Machine Intelligence, https://doi.org/10.1038/s42256-024-00792-z
内容来源于网络,如有侵权,请联系删除。
适应症
-药物
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。