预约演示
研究发现促进肝细胞癌远处转移的新机制
2023-09-11
近日,中山大学附属第三医院杨扬教授肝脏外科团队与中山大学中山医学院项鹏教授团队合作在肝脏病学顶级期刊Journal of Hepatology在线发表题为“Combined inhibition of surface CD51 and γ-secretase-mediated CD51 cleavage improves therapeutic efficacy in experimental metastatic hepatocellular carcinoma”的研究论文。
该研究发现整合素家族蛋白CD51促进肝细胞癌远处转移的全新机制,为以整合素为靶点的综合肿瘤治疗提供了重要理论支撑,开拓了未来发展思路,具有很强的临床转化价值。中山大学附属第三医院肝脏外科学科带头人杨扬教授,中山大学中山医学院项鹏教授作为共同通讯作者。
肝细胞癌(hepatocellular carcinoma, HCC)作为全球第二大致死恶性肿瘤,在确诊时往往已伴发远处转移,严重限制了肝癌患者预后。然而针对其远处转移,目前可用的治疗手段十分有限。进一步明确肝癌在远处转移中的关键环节,进而开发相应的靶向治疗策略,对改善晚期肝癌患者预后至关重要。
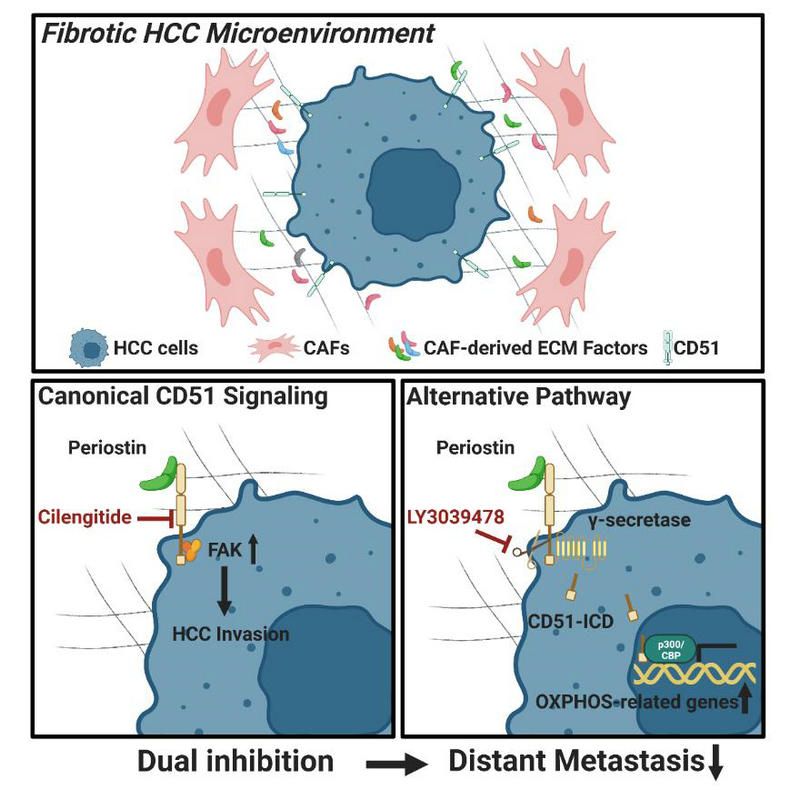
由于HCC患者通常有明确的前驱病理学改变,即“肝炎-肝硬化-肝癌”三部曲,超过80%的HCC患者具有纤维化或肝硬化背景。针对这一特征,大量研究证实了纤维化肿瘤微环境与肝癌恶性进展及患者预后的高度相关性。作为主要胞膜蛋白家族之一,整合素家族是肿瘤细胞与微环境密切通讯的关键媒介,对于多种实体肿瘤侵袭、转移均具有促进作用。也因此,整合素家族被认为是极具前景的晚期肿瘤治疗靶点。其中,针对整合素αv(CD51)的药物开发与临床试验最为火热。以西仑吉肽(cilengitide)作为代表的小分子CD51抑制剂在临床前及早期临床研究中均表现出良好的安全性及抗肿瘤效果。然而,在大规模III期临床研究中,cilengitide却并未展现出有效的抗肿瘤效应,研究最终以失败告终,失败的原因也尚未阐明。
针对这一问题,研究人员系统性阐明了CD51作为肿瘤转移关键分子,存在一种潜在的作用机制“逃逸”了西仑吉肽的抑制作用。具体而言,CD51可接受γ-分泌酶(γ-secretase)介导的跨膜切割并产生游离的CD51胞内结构域(CD51-ICD)。而CD51-ICD能够“忽视”西仑吉肽的抑制作用而独立发挥促肿瘤效应。进一步,研究人员通过多种临床相关动物模型发现当联合γ-分泌酶抑制剂LY3039478时,以西仑吉肽为基础的治疗显示出显著改善的抗肿瘤效应。这一发现提示西仑吉肽及LY3039478联合疗法是一种具有前景的肝癌治疗策略,为在临床环境中重新评估西仑吉肽提供了理论基础,并强调了在未来针对CD51的临床试验中确定更精确的患者亚群的重要性。
Preview
来源: 生物谷
机制模式图
更多内容,请访问原始网站
文中所述内容并不反映新药情报库及其所属公司任何意见及观点,如有版权侵扰或错误之处,请及时联系我们,我们会在24小时内配合处理。
靶点
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。



