预约演示
研究揭示炎症促进肿瘤免疫治疗抵抗新机制
2023-06-05
免疫疗法
Preview
来源: 生物谷
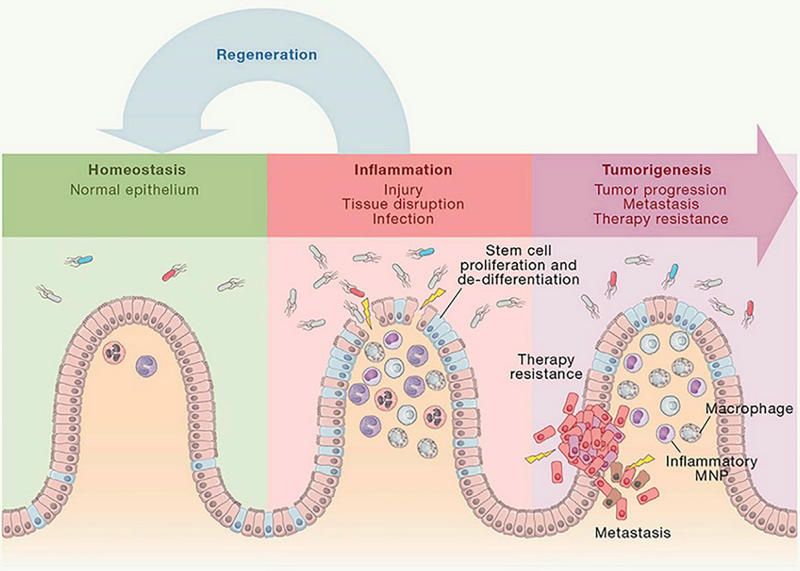
炎癌转化假说(引自Immunity. 2019 Jul 16;51(1):27-41)

Preview
来源: 生物谷
研究示意图
中山大学肿瘤防治中心徐瑞华教授、鞠怀强研究员为论文的通讯作者。中山大学肿瘤防治中心博士后韩轶、张燕宇和潘艺芊为论文的共同第一作者。研究工作也得到了中山大学肿瘤防治中心黄蓬教授、袁庶强副主任医师、刘泽先研究员、曾昭蕾副研究员、吴其年副主任医师和南方医科大学杨魏教授及郑晓君副研究员等合作者的大力支持。
更多内容,请访问原始网站
文中所述内容并不反映新药情报库及其所属公司任何意见及观点,如有版权侵扰或错误之处,请及时联系我们,我们会在24小时内配合处理。
药物
-生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。



