预约演示
前沿 |《科学》子刊:三阴性乳腺癌治疗新策略——靶向这种免疫细胞
免疫疗法细胞疗法临床研究
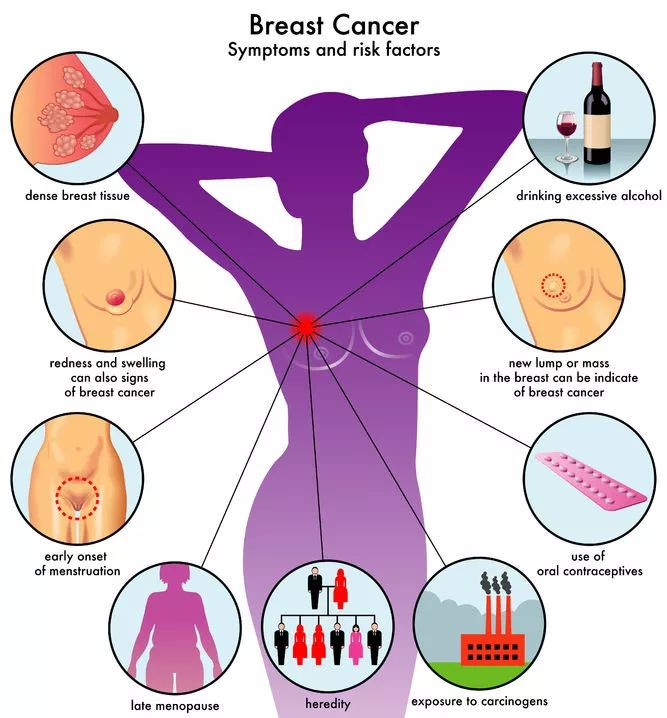
乳腺癌是最为常见的癌症类型,2020年的一项最新统计显示,当年 全球约新增230万名乳腺癌患者,造成68.5万名患者死亡。其中,三阴性乳腺癌(TNBC)是乳腺癌最具侵袭性的分子亚型之一,占所有乳腺癌病例的10%-15%, 其特征是缺乏雌激素和孕酮受体(ER/PR)以及缺乏人表皮生长因子受体-2(HER2)。
Preview
来源: 药明康德
最近,宾夕法尼亚大学(University of Pennsylvania)的研究团队利用单细胞RNA测序技术和功能分析针对TNBC肿瘤微环境中的NK细胞展开了研究,详细分析了它的细胞组成和功能,并探讨了潜在的治疗策略。研究结果已整理发表于《科学》杂志子刊Science Translational Medicine上。

Preview
来源: 药明康德
Preview
来源: 药明康德
锁定“嫌疑”细胞群后,研究人员开始着手分析NK细胞的特性及其在肿瘤微环境中所起的作用。经分析,在侵袭性TNBC小鼠中,其肿瘤NK细胞中负责细胞毒性和NK细胞激活功能的基因表达被下调,并且部分NK细胞亚群的颗粒酶表达也减少,表明这类小鼠TME中的NK细胞对于癌细胞的杀伤能力降低。此外,基因集富集分析结果显示,NK细胞有着更高的炎症反应水平,它们很可能在TNBC肿瘤微环境中发挥着促炎作用。不仅如此,研究人员还发现了未成熟的NK细胞在TNBC肿瘤中数量增加,并且伴有PD-L1及血管生成相关标志物表达升高。在多个侵袭性TNBC肿瘤小鼠TME中,研究人员也观察到了NK细胞的高频率出现,而非TNBC小鼠中则不然。TNBC肿瘤微环境中存在的NK细胞具有明显的表型差异,并且没有完全成熟。和前文的分析一样,它的确与肿瘤转移和血管生成相关。
Preview
来源: 药明康德
参考资料:[1] Thacker, Gatha et al. “Immature natural killer cells promote progression of triple-negative breast cancer.” Science translational medicine vol. 15,686 (2023): eabl4414. doi:10.1126/scitranslmed.abl4414
内容来源于网络,如有侵权,请联系删除。
机构
-生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。


