预约演示
中山大学第一附属医院研究者们揭示了靶向SLC7A11治疗骨肉瘤的可行性和临床前景
2023-08-29
临床结果申请上市
OS的全基因组和外显子组测序揭示了OS的基因组格局,并突显了染色体蓟马病的流行,这是一种在某些基因组区域同时发生染色体重排的现象,在OS患者中产生大量基因组突变。

Preview
来源: 生物谷
图片来源:https://doi.org/10.1038/s41419-023-05966-y
MLX表达上调预示骨肉瘤预后不良。MLX基因敲除对骨肉瘤生长和转移的影响。转录测序表明,MLX参与多种代谢途径(如脂类代谢),并可诱导代谢重编程。此外,MLX基因敲除导致亚铁的运输和储存受到干扰,导致细胞内亚铁水平增加,继而诱发铁死亡。
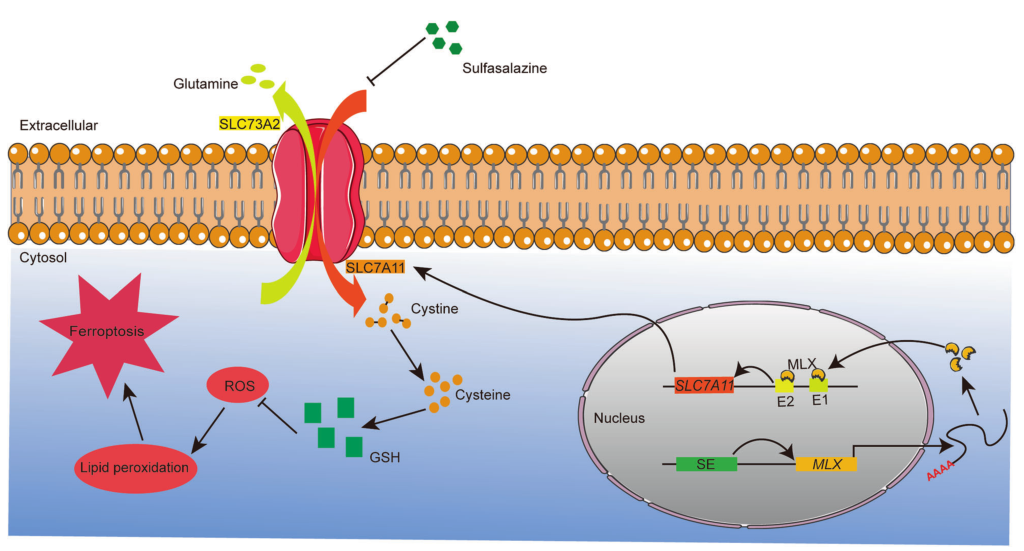
Preview
来源: 生物谷
图片来源:https://doi.org/10.1038/s41419-023-05966-y
参考文献
Weitang Guo et al. Super-enhancer-driven MLX mediates redox balance maintenance via SLC7A11 in osteosarcoma. Cell Death Dis. 2023 Jul 17;14(7):439. doi: 10.1038/s41419-023-05966-y.
更多内容,请访问原始网站
文中所述内容并不反映新药情报库及其所属公司任何意见及观点,如有版权侵扰或错误之处,请及时联系我们,我们会在24小时内配合处理。
药物
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。



