预约演示
更新于:2025-05-07

Dongguan HEC TaiGen Biopharmaceuticals Co., Ltd.
东莞东阳光太景医药研发有限责任公司|子公司|2017|中国广东省
东莞东阳光太景医药研发有限责任公司|子公司|2017|中国广东省
更新于:2025-05-07
概览
关联
2
项与 东莞东阳光太景医药研发有限责任公司 相关的药物靶点 |
作用机制 NS5A抑制剂 |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症 |
最高研发阶段批准上市 |
首次获批国家/地区 中国 |
首次获批日期2020-12-21 |
靶点 |
作用机制 NS3/NS4A抑制剂 |
在研机构- |
原研机构 |
在研适应症- |
非在研适应症 |
最高研发阶段无进展 |
首次获批国家/地区- |
首次获批日期- |
14
项与 东莞东阳光太景医药研发有限责任公司 相关的临床试验CTR20190878
评价伏拉瑞韦、磷酸依米他韦与利巴韦林联合给药在慢性丙型肝炎基因1型受试者中的疗效和安全性III期研究
评价伏拉瑞韦胶囊、磷酸依米他韦胶囊与利巴韦林联合给药12周在慢性丙型肝炎病毒基因1型受试者中的疗效与安全性。
开始日期2019-06-13 |
申办/合作机构  东莞东阳光太景医药研发有限责任公司 东莞东阳光太景医药研发有限责任公司 [+1] |
NCT04155515
A Phase III, Multicenter, Open-labeded Study To Evaluate Efficacy and Safety of TG-2349 in Combination With DAG181 and Ribavirin for 12 Weeks of Treatment in HCV Genotype I Infected Patients
A Phase III, Multicenter, open-labeded study to Evaluate Efficacy and Safety of TG-2349 in Combination With DAG181 and Ribavirin for 12 weeks of treatment in HCV Genotype I Infected Patients
开始日期2019-06-13 |
申办/合作机构 |
CTR20190883
评价伏拉瑞韦、磷酸依米他韦与利巴韦林联合给药在慢性丙型肝炎基因1型受试者中的疗效和安全性III期研究
评价伏拉瑞韦胶囊、磷酸依米他韦胶囊与利巴韦林联合给药12周在慢性丙型肝炎病毒基因1型受试者中的疗效与安全性。
开始日期2019-06-13 |
申办/合作机构  东莞东阳光太景医药研发有限责任公司 东莞东阳光太景医药研发有限责任公司 [+1] |
100 项与 东莞东阳光太景医药研发有限责任公司 相关的临床结果
登录后查看更多信息
0 项与 东莞东阳光太景医药研发有限责任公司 相关的专利(医药)
登录后查看更多信息
1
项与 东莞东阳光太景医药研发有限责任公司 相关的新闻(医药)2021-03-20
近日,2020年的GDP业绩公布,广东省以11万亿元继续排名第一,和“十三五”初2015年的排名一样。江苏省以10亿元屈居第二。然而,广东的药品研发并没有如它的GDP那样亮眼。
若以新药品注册管理办法实施后获批的产品作为评判研发能力的标准,2017年以后,来自广东化学药获批的1类新药仅有3个,若按新注册分类,则只有1个获批。获得批文的三家广东企业,都不是进入2019年度中国医药工业百强的企业。宜昌东阳光2020年获批了一个1类新药磷酸依米他韦胶囊,上市许可持有人地址属于湖北省,该批文暂未统计在广东省的批文范围内。
数据来源:咸达药海数据库
广东的医药百强如今在做些什么?
根据2019年度中国医药工业百强榜的数据,广东共有5家企业进入百强榜,分别是广州医药、联邦制药、东阳光药、丽珠医药与信立泰。这五家近年以新注册分类获批的化学药,基本上都是仿制药。丽珠的注射用艾普拉唑钠以旧2类在2017年获批,是广东头部制药企业为数不多的改良创新药获批。
数据来源:咸达药海数据库
如果不以获批情况“论英雄”,广东的1类化学药新药的申报情况是如何呢?或许我们能从中看出端倪。
首先,创新类的药品获批较少,直接原因是申报较少。
以广州医药集团为例,广药仅申报了注射用头孢嗪脒钠一个产品,2017年获批临床,截至2020年,该药在CDE中显示的研发进度是,启动注射用头孢嗪脒钠单次给药安全性、耐受性及药动学研究的临床研究。
其次,创新药的研发风险比较大也是不能回避的问题。
以东阳光为例,作为广东省1类化学药申报最多的企业,目前仅有一个治疗丙肝的药物依米他韦上市。根据研究进度,下一步有可能上市的产品是处于临床Ⅲ期的丙肝类药物伏拉瑞韦和焦谷氨酸荣格列净。其余药物从进度来看,还要至少等3年才能看到是否能上市。
另外值得关注的是,一些2017年没有启动的临床批件,2018年启动了临床Ⅰ期,没有进一步进展的,都很有可能是不会继续的项目。
按这样的标准评估,东阳光可能已经砍掉9个新药项目。
若以一个项目临床前投入成本2500万元,Ⅰ期临床投入成本3500万元估算,6个项目进入Ⅰ期,3个临床前。
预计东阳光在研发项目的投入就将近3亿元,此数据还未包括新药研发五年的配套的原料药、制剂和临床的人力资源的投入。
东阳光化学药在研产品线
类型
项目名称
适应证
状态
抗感染
依米他韦
丙肝
2020年上市
伏拉瑞韦
丙肝
Ⅲ期
莫非赛定
乙肝
Ⅱa期
HEC110114
丙肝
Ⅰb/Ⅱa期
HEC84048/康达瑞韦
丙肝
Ⅰ期(2018年)
HEC74647
丙肝
Ⅰb期
盐酸哌博赛定
乙肝
临床批件(2020年)
NS5B聚合酶抑制剂,
丙肝
临床批件(2017年)
抗肿瘤
宁格替尼/ CT053
肺癌/白血病/肾癌/肝癌
Ⅰb期
莱洛替尼
食管鳞癌/胰腺癌
食管鳞癌Ⅲ期、胰腺癌Ⅰb期
英利替尼
乳腺癌
Ⅰ期(2016年)
克立福替尼
复发/难治急性髓系白血病
Ⅰ期(2018年)
CT365-Na/HEC68498
实体瘤
Ⅰ期(2018年)
HEC89736PTSA·0.5H2O
复发难治B细胞血液肿瘤
Ⅰ期
CT413
实体瘤
临床前(2015年)
代谢疾病
焦谷氨酸荣格列净
2型糖尿病
Ⅲb期
HEC96719
非酒精性脂肪性肝炎
Ⅰ期
HEC53856
肾性贫血
Ⅰ期
HEC73077
糖尿病肾脏疾病
临床批件(2021年)
HEC88473 注射液(GLP-1/FGF2121双功能分子)
糖尿病
临床批件(2021年)
其它
伊非尼酮
特发性肺纤维化
Ⅱ期
HEC30654AcOH
阿尔茨海默病
Ⅰ期(2018年)
HEC122505MsOH
帕金森病
Ⅰ期
利他匹仑
支气管哮喘
Ⅰ期(2018年)
HEC83518
失眠症
Ⅰ期
HEC113995
抑郁症
Ⅰ期
HEC81885对甲苯磺酸盐胶囊
未详
临床批件(2018年)
HEC116094HCl·3H2O
甲流
临床批件(2021年)
数据来源:咸达药海数据库
2021年失败的案例还有百奥泰。
2021年2月,百奥泰公告终止 BAT8001 (即注射用重组人源化抗 HER2 单克隆抗体-美登素偶联物,以下简称“BAT8001”) 临床试验。
2021年3月,百奥泰发布公告,称其研发的 BAT8003 (即注射用重组人源化抗 Trop2 单克隆抗体-美登素偶联物,以下简称“BAT8003”) 和 BAT1306(即重组人源化抗 PD-1 单克隆抗体注射液,以下简称“BAT1306”) 处于临床研究阶段。
经百奥泰审慎考量该药物的后续开发风险,决定终止该项目的临床试验。
BAT8001针对HER2阳性乳腺癌的III期临床研究是一项国内多中心、随机、开放、阳性对照、优效性的Ⅲ期临床研究。
截至2020年百奥泰该项目研发投入累计2.26亿元。
BAT8003是百奥泰自主开发的一种创新药物,是一种靶向Trop2的ADC药物,由糖基化修饰的重组人源化抗Trop2单克隆抗体通过定点偶联技术与Batansine进行共价连接而成。
截至2020年12月31日,BAT8003项目研发投入累计6156.5万元。
BAT1306是公司开发的针对免疫抑制检查点PD-1的单克隆抗体,单药适应证为EBV相关性胃癌,目前已开展BAT1306联合XELOX一线治疗EBV相关胃癌临床试验及BAT8001联合BAT1306二线治疗HER2阳性晚期实体瘤的临床试验。
截至2020年12月31日,BAT1306项目研发投入累计5197.45万元。
第三,新药研发周期较长,不确定性高。
新药的研发周期较长,按照目前国内的法规要求,临床前的研究信息只能从文献和会议报道获取。
新药获得临床批件后,理想状态下,I期和Ⅱ期基本都需要1到2年,Ⅲ期需要2-3年。
例如中山康方的生物制品AK101注射剂2017年9月获批临床,但是2020年还没能正式启动Ⅲ期临床研究。
中山康方AK101注射剂临床时间表
序号
登记号
试验分期
药物名称
试验通俗题目
1
CTR20201627
Ib期
AK101注射液
AK101治疗中重度活动性溃疡性结肠炎
2
CTR20201440
Ⅱ期
AK101注射液
AK101注射液(靶向IL-12/23p40单抗)治疗中、重度斑块型银屑病
3
CTR20190534
Ⅱb期
AK101注射液
AK101注射液治疗中、重度斑块型银屑病Ⅱb期临床试验
4
CTR20171655
I/Ⅱ期
AK101注射液
AK101注射液中重度斑块银屑病患者I/Ⅱ期临床研究
数据来源:CDE
化学药新注册分类发布到2021年3月的时间太短,不足以支持产品完成临床Ⅰ期、Ⅱ期到Ⅲ期整个完整的临床研究。
除了符合附条件上市的标准完成Ⅱ期临床即可申报上市的新药,其余新药都要完成临床研究Ⅲ期才能申报。
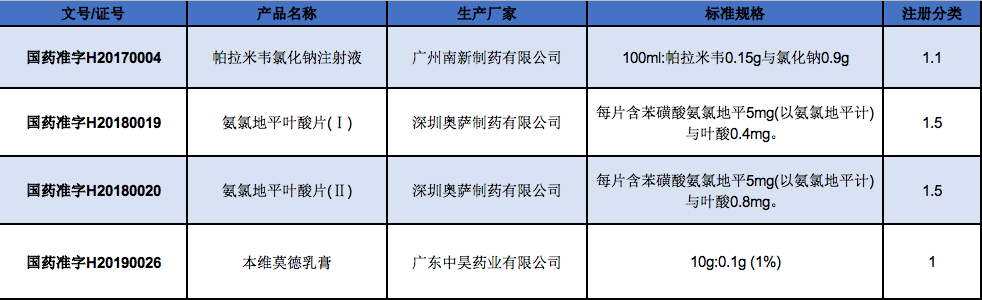
化学药新注册分类发布后,广东共申报了五个1类新药的上市申请,其中上文提及的苯烯莫德乳膏和磷酸依米他韦胶囊已获批上市。
派安普利单抗注射液是广东企业第一个也是唯一一个申报上市的PD-1注射液,申报上市时间为2020年。
相较于2018年君实生物PD-1特瑞普利单抗注射液获得国家药监局有条件批准上市,成为了首个获批上市的国产PD-1产品,整整慢了2年。
广东一个省申报1类新药上市的产品数,比不上恒瑞一家申报的数量。
受理号
药品名称
企业名称
CXSS2000022
派安普利单抗注射液
中山康方生物医药有限公司;正大天晴康方(上海)生物医药科技有限公司
CXHS2000038
奥瑞巴替尼片
广州顺健生物医药科技有限公司;上海宣泰海门药业有限公司
CXHS1900032
西格列他钠片
成都微芯药业有限公司;深圳微芯生物科技股份有限公司
CXHS1600008
苯烯莫德乳膏
广东中昊药业有限公司;北京文丰天济医药科技有限公司;深圳天济药业有限公司
CXHS1900030
磷酸依米他韦胶囊
宜昌东阳光长江药业股份有限公司;东莞东阳光太景医药研发有限责任公司;广东东阳光药业有限公司
数据来源:咸达药海数据库
广东的研发为啥迟迟不出成果?
广东省是国内药品销售市场规模最大的省,历来都是各个药企营销必定布局的省份。
但是近年来,广东的药品研发所展示的成绩单远远比不上江苏。
沪深股市中,化学制药的市值排名(由高到低)中,2021年3月16日雪球数据展示,江苏恒瑞以4737亿排名第一,广东省的信立泰和丽珠集团分别以377亿和335亿分别排名第7和第10。
生物制品领域,广东没有一家上市企业的市值能挤进前10。
港股康方生物380亿市值有挤进前10的潜力。
广东省之所以拼不过江苏省,可能原因如下:
首先,广东省只是一个省在战斗,江苏省和上海、浙江等省份紧密合作,已经形成产业协同效应。浙江省的原料药出口经过多年的积累,个别原料药产品已经是在全球具备成本优势。
广东省的企业大部分是国内流通起家,医药流通改革前靠着政策红利已经活得很滋润了,并没有积极布局原料药。广东省附近的省份如福建也没有像浙江省发展原料药进出口的生意,整个珠三角并没有建立良好的原料药基础。原料药的困境同样也体现在CRO机构,广东的CRO数量也没有长三角的多。
其次,广东企业更喜欢“取巧”。
集中带量采购后,成本管理具备竞争优势的原料制剂一体化企业更能够获得市场。没有原料优势的广东企业在竞争中更多是取巧胜出,例如第四次集采中花园药业的招标价格较高,赢得更高的市场规模引起行业热议。这其实就是广东药品企业的文化——政策机会型企业,政策导向在哪就往哪布局,更偏好读懂规则后利用规则获得更高的利润。这意味着哪类项目短期收益回报越快,广东企业就更愿意投入,重资产回报慢的项目往往在广东不受青睐。
第三,政府的投入。
广州和深圳这两年终于启动生物医药的抢人抢项目的战争。但是生物制品越到研发后期越难变更生产产地,也就是说广东省已经错过了PD-1、CAR-T最佳的发展阶段,百济神州虽然在广州有生产基地,但并不是其总部,研发核心也不在广州。这意味着未来三年的行业的生物制品的亮点业绩基本与广东无关。ADC、双抗、核酸药物或许还有争夺的机会,其中中山康方可能在双抗领域有所突破。
第四,人才的缺乏。
广东药品相关的研发高校并不多,实力最强的可能就是中山大学。中国药科大学每年毕业的学生通常会优先选择长三角,流到珠三角的人才并不多。广东最近的高校实力较强的中南大学(湘雅医学院)和湖北武汉两大领域也没有紧密的合作和人力的引流。
高技术型人才方面,广东研发人员的薪酬和长三角对比并没有优势,这主要是广东的现有的药企的营业收入水平一般,而且大部分广东的老板非常讲究年度利润业绩,根据自己的利润体量去测算研发团队的薪酬。
此外,广东的老板大多数不是研发出身而是市场营销出身,往往用营销市场的管理方法去管理研发团队,营销团队往往讲究的狼群效应,更愿意奖励头狼,但是研发更讲究的是合作,每一个环节都要达标,必须要和谐共赢的氛围,老板如果没有把关键核心环节的关键人员都照顾好,很难出成果。
因此,广东可能会出成果的企业只能期待是有技术并且有市场触觉的大牛回来创业。
抗体免疫疗法抗体药物偶联物创新药
100 项与 东莞东阳光太景医药研发有限责任公司 相关的药物交易
登录后查看更多信息
100 项与 东莞东阳光太景医药研发有限责任公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2026年02月28日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
其他
2
登录后查看更多信息
当前项目
| 药物(靶点) | 适应症 | 全球最高研发状态 |
|---|---|---|
磷酸依米他韦 ( NS5A ) | 慢性丙型肝炎基因型 1 更多 | 无进展 |
伏拉瑞韦 ( NS3/NS4A ) | - | 无进展 |
登录后查看更多信息
药物交易
使用我们的药物交易数据加速您的研究。
登录
或

转化医学
使用我们的转化医学数据加速您的研究。
登录
或

营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或

科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或

投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或

融资
发掘融资趋势以验证和推进您的投资机会。
登录
或

生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用

