Delandistrogene moxeparvovec——首个DMD基因疗法
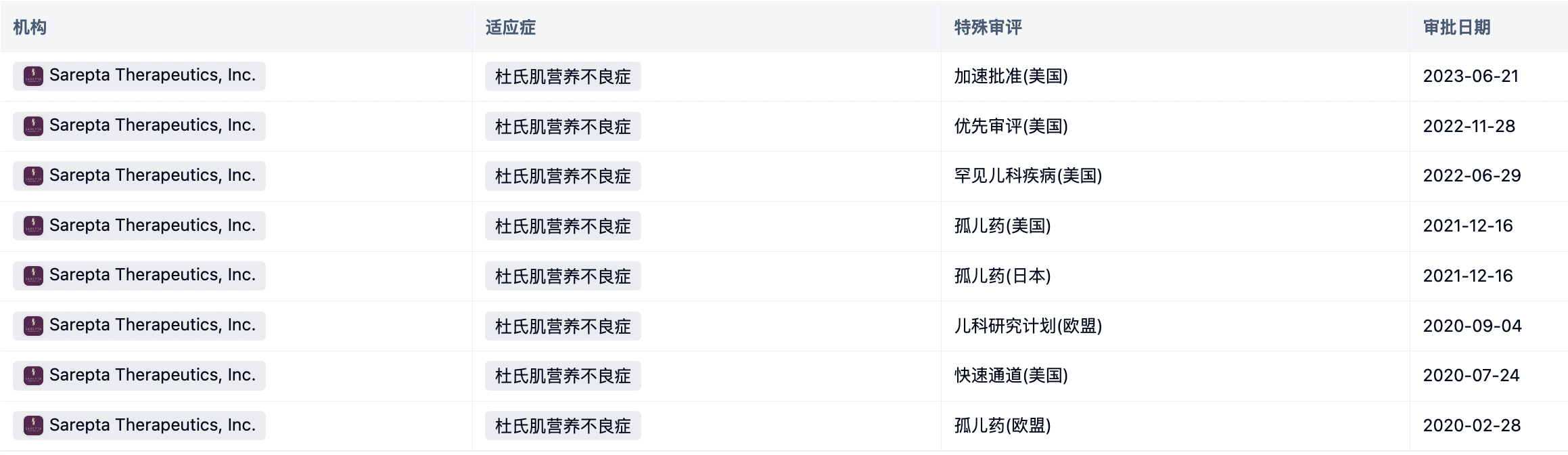
Delandistrogene moxeparvovec注射剂,又称SRP-9001,商品名ELEVIDYS,是一种靶向micro-dystrophin的腺相关病毒基因疗法。该药物由Nationwide Children’s Hospital开发,在2023年6月21日获得FDA的批准,用于治疗4至5岁患有Duchenne肌营养不良症(以下简称:DMD)且DMD基因已确认突变的门诊患儿。该适应症在”加速批准”通道下获批,其后期的持续性还要取决于验证性试验中对临床益处的证明和描述。
Delandistrogene moxeparvovec是FDA批准的首个治疗DMD的基因疗法。该药物在研发过程中获得多项特殊审评认证,更多详细数据,请点击下方图片链接获取。
DMD是一种罕见且严重的遗传性疾病,它的发生是由于基因缺陷导致肌营养不良蛋白(抗肌萎缩蛋白)的缺失,肌营养不良蛋白是一种有助于保持人体肌肉细胞完整的蛋白质。由于这种遗传缺陷,患有DMD的人可能会出现行走困难、经常跌倒、疲劳、学习障碍/困难、心肌性心脏问题以及由于心肌功能减弱而出现呼吸问题等症状。通常始于3-6岁的儿童,主要为男性,大约每3,300个男孩中就有一个患有这种疾病,随着时间的推移,病情会逐渐恶化,患者通常在20、30多岁时因心脏和/或呼吸衰竭而死亡。
作用机制
Elevidys 是一种重组基因疗法,旨在将一种基因输送到体内,从而产生Elevidys微肌营养不良蛋白,这是一种缩短了基因序列的短序列蛋白质(138 kDa,而正常肌肉细胞的肌营养不良蛋白为 427 kDa),存在于正常的肌肉细胞中。
临床结果
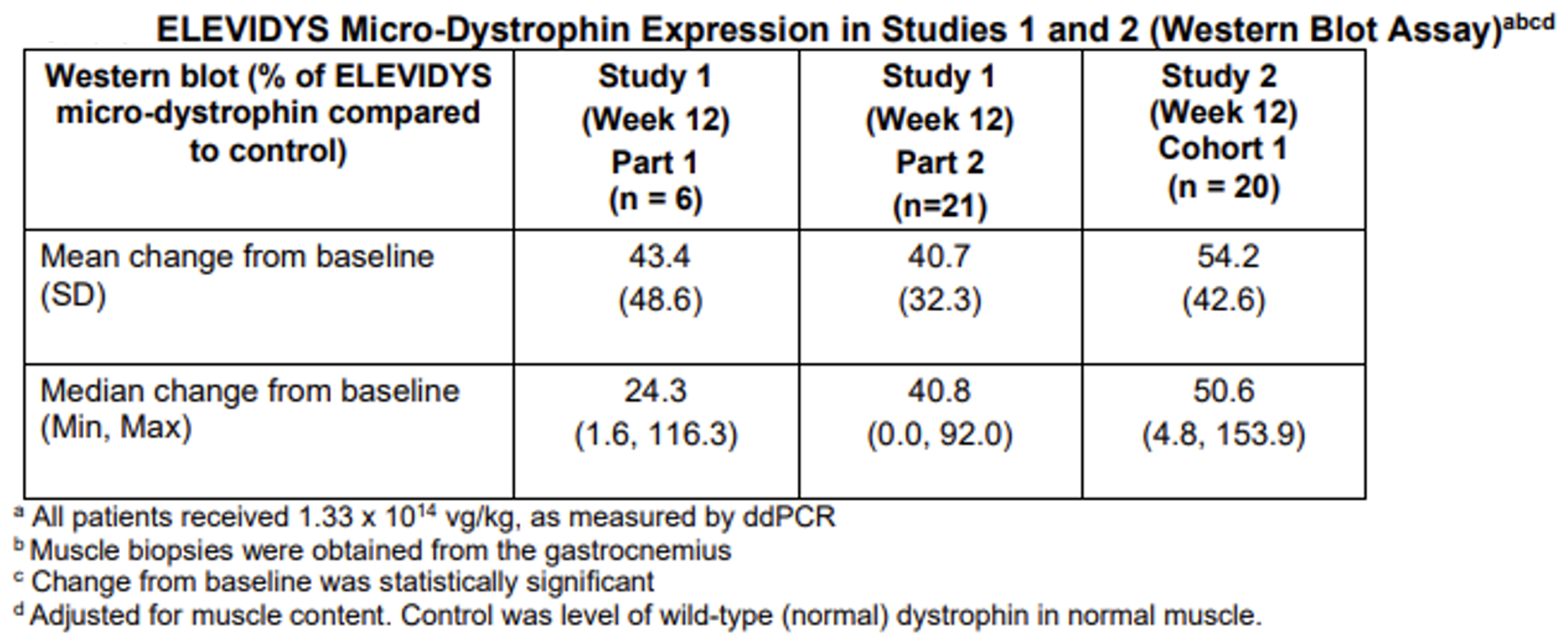
Elevidys 为“加速批准”,其临床益处尚未完全确定。该批准基于一项随机临床试验数据(图2-7),在接受Elevidys 治疗的4至5岁DMD患者中观察到Elevidys微肌营养不良蛋白的表达增加了。上市后公司还需继续完成试验并尽快审查试验数据。
最常见的副作用是呕吐、恶心、急性肝损伤、发热和血小板减少症。在使用Elevidys治疗前应监测患者的肝功能,并在治疗后的前三个月每周监测一次。接受Elevidys治疗的患者也可能面临严重免疫介导性肌炎的风险。此外,在临床试验中使用Elevidys后,观察到心肌炎和肌钙蛋白-I的升高,因此在服用 Elevidys 之前应监测肌钙蛋白-I 水平,并在治疗后第一个月每周监测一次。
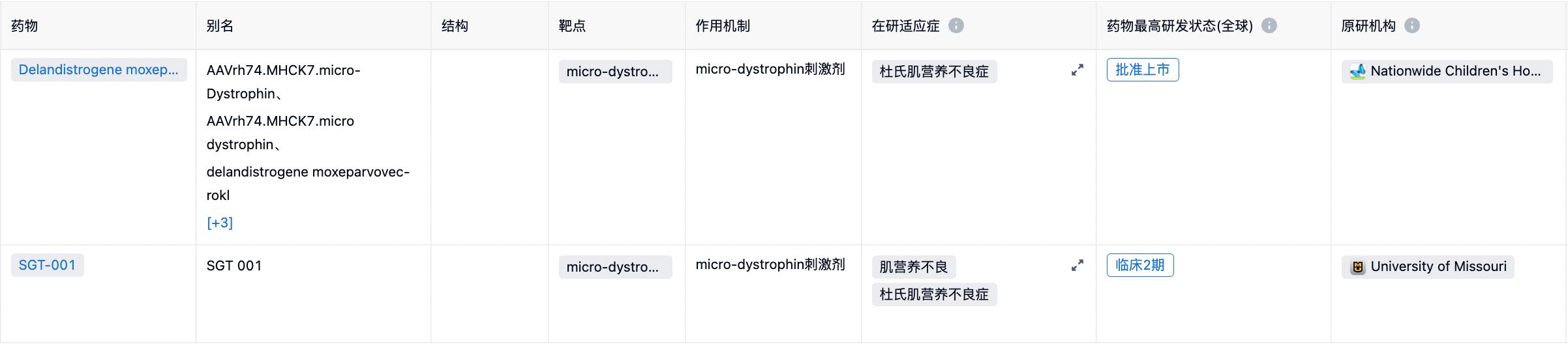
竞争格局
目前大多数治疗方法只针对该疾病的症状,包括使用皮质类固醇药物、锻炼来减缓肌肉无力的进展,或使用反义寡核苷酸 (ASO) 药物治疗特定 DMD 基因突变的患者,这些治疗的效果和范围有限。若Elevidys 的临床获益在后期的研究中得到进一步确认,将在很大程度上解决迫切、未满足的临床需求。其潜在同靶点竞品为University of Missouri开发的SGT-001,目前处于临床2期,同样获得FDA的多种特殊审评认证。更多详细数据,请点击下方图片链接获取。