和黄医药VEGFR 1/2/3抑制剂呋喹替尼于香港获批,用于治疗转移性结直肠癌
2024年1月30日,和黄医药宣布爱优特®(ELUNATE®,呋喹替尼,fruquintinib)取得香港药剂业及毒药管理局批准在香港注册使用,用于治疗经治的成人转移性结直肠癌患者。
呋喹替尼是一种口服药物,属于高选择性和强效的VEGFR1 + VEGFR2 + VEGFR3抑制剂。其独特设计旨在提高激酶选择性,以尽可能减少脱靶毒性,改善耐受性,并增强对靶点的稳定覆盖。呋喹替尼于2018年09月04日获NMPA批准上市,适用于既往接受过氟尿嘧啶类、奥沙利铂和伊立替康为基础的化疗,以及既往接受过或不适合接受抗血管内皮生长因子(VEGF)治疗、抗表皮生长因子受体(EGFR)治疗(RAS野生型)的转移性结直肠癌(mCRC)患者。2023年3月,武田与和黄医药达成了独家许可协议,该协议使得在中国大陆、香港和澳门以外的全球范围内推进呋喹替尼的开发、商业化和生产成为可能。此前,该药已在中国获得批准,用于治疗经过氟嘧啶、奥沙利铂和伊立替康治疗后的转移性结直肠癌患者。2023年11月9日,和黄医药宣布呋喹替尼获得FDA批准上市,用于治疗经治转移性结直肠癌成人患者,成为美国首个且唯一获批用于治疗经治转移性结直肠癌的针对全部三种VEGF受体的高选择性抑制剂。

本次获批主要是基于FRESCO-2国际多中心临床试验的积极结果。FRESCO-2研究旨在探索呋喹替尼联合最佳支持治疗对比安慰剂联合最佳支持治疗用于治疗难治性的转移性结直肠癌患者的疗效和安全性。试验结果表明,与安慰剂相比,呋喹替尼组在主要终点总生存期(OS)和关键次要终点无进展生存期 (PFS) 均达到具有统计学意义和临床意义的显著延长。具体而言,461例接受呋喹替尼治疗的患者中位OS为7.4个月,而230例安慰剂组患者的中位OS为4.8个月(HR:0.66;95% CI:0.55–0.80;p<0.001)。接受呋喹替尼治疗的患者的中位PFS为3.7个月,而安慰剂组患者的则为1.8个月(HR 0.32;95% CI 0.27–0.39;p<0.001)。呋喹替尼组的疾病控制率 (DCR) 为55.5%,而安慰剂组为16.1%。两组患者的中位随访时间均约为11个月。FRESCO-2研究中呋喹替尼的安全性特征与之前公布的呋喹替尼临床试验中已知的特征一致。
2023年6月16日,武田(Takeda)与和黄医药宣布,欧洲药品管理局(EMA)已确认并受理呋喹替尼用于治疗经治转移性结直肠癌成人患者的新药上市申请;同时,该产品治疗经治转移性结直肠癌的3期FRESCO-2研究结果于《柳叶刀》发表。
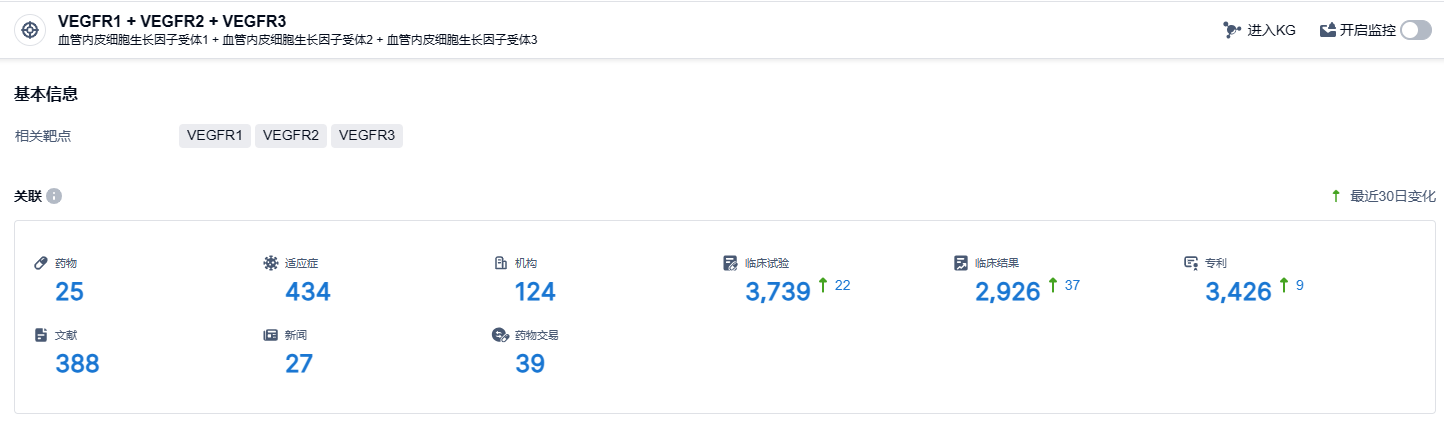
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达VEGFR1 + VEGFR2 + VEGFR3靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年1月31日,VEGFR1 + VEGFR2 + VEGFR3靶点共有在研药物25个,包含的适应症有434种,在研机构124家,涉及相关的临床试验3739件,专利多达3426件……呋喹替尼试验数据优秀,为国产新药出海记录增加浓墨重彩的一笔。