强生BCMA/CD3双抗Teclistamab在国内申报上市,治疗多发性骨髓瘤
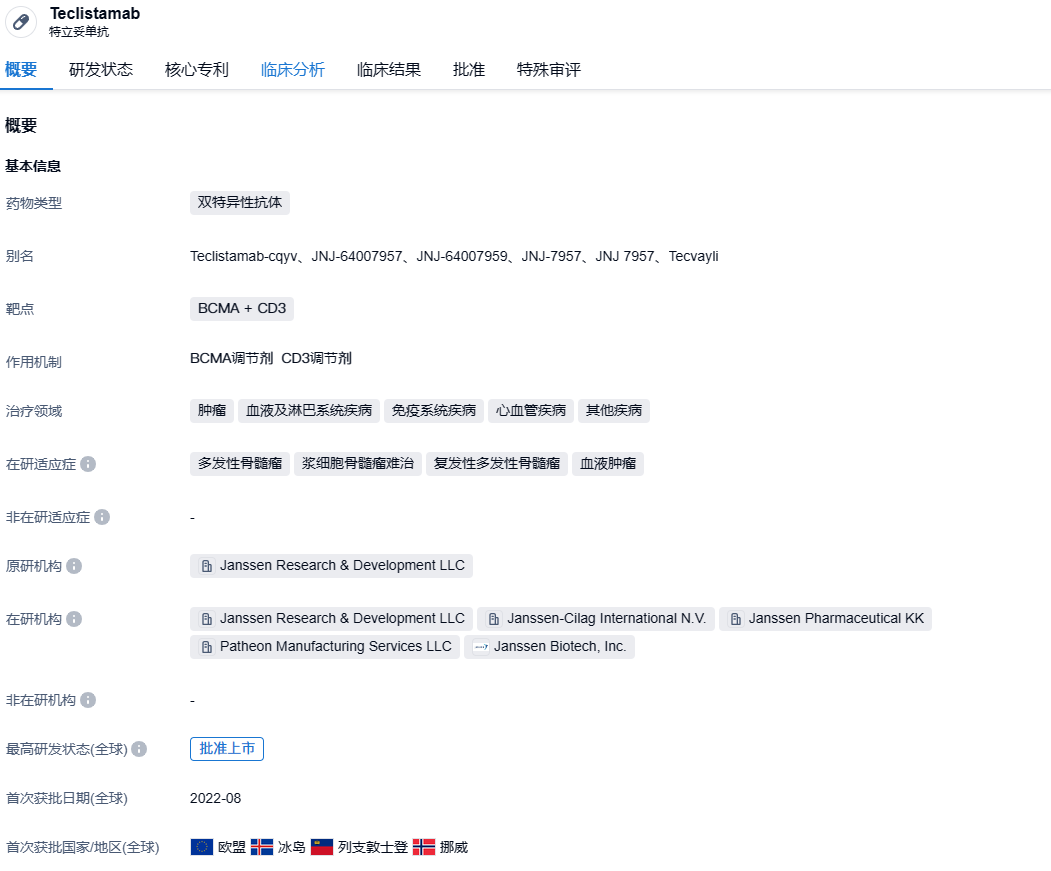
2023年8月 21 日,CDE 官网显示,强生制药的BCMA/CD3双特异性抗体特立妥单抗(Teclistamab)在国内的上市申请已获受理,并被纳入优先审评程序,单药用于既往接受过至少三种治疗(包括一种蛋白酶体抑制剂、一种免疫调节剂和一种抗 CD38 单克隆抗体)的复发或难治性多发性骨髓瘤(MM)成人患者。
Teclistamab(JNJ-64007957/JNJ-7957)是利用Genmab的DuoBody双特异抗体平台构建的1+1非对称双特异性抗体,靶向BCMA/CD3,抗体骨架为IgG4并进行PAA突变去除IgG4的天然交换特性和Fc的相关功能(ADCC,CDC)。2022年8月25日,欧盟委员会(EC)批准了BCMA/CD3双特异性抗体Tecvayli(Teclistamab)有条件上市,适应症为单药治疗复发/难治性多发性骨髓瘤(RRMM)成人患者。2022年10 月 25 日,Teclistamab获 FDA 批准在美国上市,商品名为 Tecvayli。作为一款双抗皮下注射剂,Teclistamab在依从性方面具备优势。值得一提的是,这是强生的第 4 款多发性骨髓瘤疗法,强生将有望重新定义多发性骨髓瘤的治疗格局。
Teclistamab 的 FDA 批准是基于 I/II 期临床试验 MajesTEC-1 研究(试验登记号:NCT04557098,NCT03145181)。这是一项单臂、开放标签、多队列、多中心剂量递增研究,以 ORR 为主要终点。关键 II 期试验纳入既往接受过中位治疗线数五线治疗的患者(n=110),其中 78% 的患者都接受过四线及以上治疗。总缓解率(ORR)达到 61.8%(95% CI:52.1%,70.9%),其中 28.2% 的患者完全缓解(CR)或严格完全缓解(sCR)。首次响应中位时间为 1.2 个月(范围:0.2 - 5.5 个月)。中位随访 7.4 个月,预估的 6 个月持续缓解(DOR)率为 90.6%(95% CI:80.3%,95.7%),9 个月 DOR 率为 66.5%(95% CI:38.8%,83.9%)。
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 BCMA/CD3 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年8月22日,BCMA/CD3靶点共有在研药物29个,包含的适应症有9种,在研机构37家,涉及相关的临床试验78件,专利多达5985件……目前已经有多款BCMA/CD3靶点新药正在积极研发中,强生的Teclistamab和辉瑞的Elranatamab已获批上市;再生元的linvoseltamab已进入临床III期;康诺亚生物的CM336、岸迈生物的EMB-06、TeneoBio/艾伯维的TNB-383B均已进入I/II期。作为首款获批的BCMA/CD3双抗,期待Teclistamab能够早日在国内上市,给国内患者带来新的治疗选择。