默沙东Ervebo疫苗获FDA批准扩大使用范围,预防埃博拉病毒感染
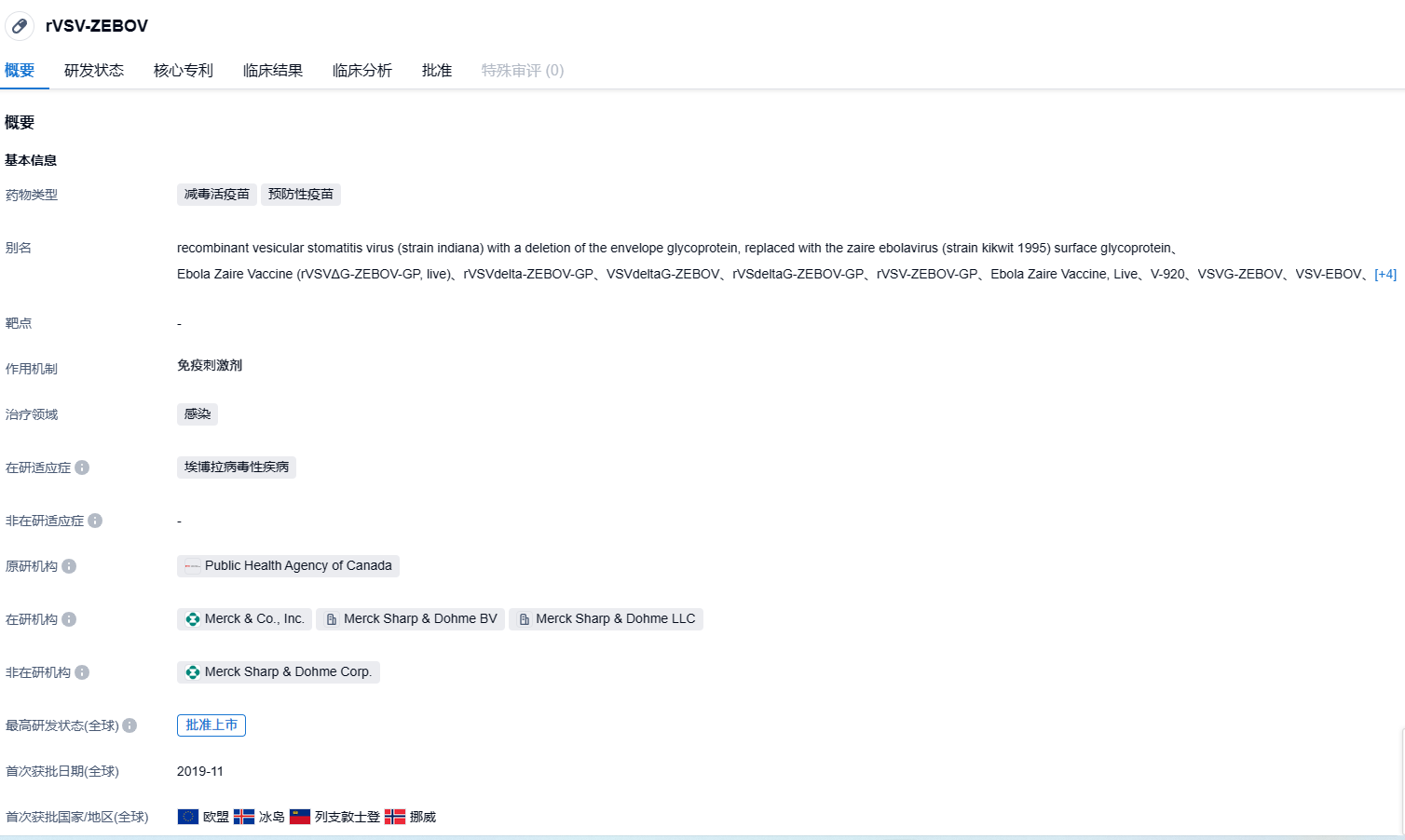
2023年8月4日,默沙东(MSD)宣布,美国FDA已批准Ervebo疫苗扩展适用范围,用于在12个月以上的个体中预防由扎伊尔埃博拉病毒(Zaire ebolavirus)感染导致的埃博拉病毒病(Ebola virus disease,EVD)。该疫苗之前已被批准用于18岁以上的个体。
Ervebo疫苗是一种无菌肌肉注射混悬液,是一种经过基因工程改造的减毒活疫苗,由水疱性口炎病毒(VSV)的主干蛋白(VSV包膜糖蛋白缺失,代之以扎伊尔埃博拉病毒的包膜糖蛋白)组成,以单剂量瓶的形式提供1mL剂量。免疫接种ERVEBO可产生免疫反应,保护患者免受扎伊尔埃博拉病毒引起的疾病,Ervebo不能预防其他埃博拉病毒或马尔堡病毒。。Ervebo疫苗在2019年首次获批,批准用于18岁以上的个体,是FDA批准的首个预防埃博拉病毒病的预防性疫苗。它最初由加拿大国家微生物实验室(Canada’s National Microbiology Laboratory)的科学家研制成功。默沙东后来获得了开发这一疫苗的权益,Ervebo疫苗曾获得美国FDA授予的优先审评资格和突破性疗法认定。
2014年疫情期间在几内亚共和国开展的一项开放标签、随机疫苗接种研究,评估了ERVEBO的临床疗效。在初步疗效分析中,将立即接种聚集性疫苗的参与者中实验室确诊的EVD病例数与延迟接种聚集性疫苗的参与者中的病例数进行了比较。随机分组后第10天至第31天发生的EVD病例纳入分析。疫苗效力为100% (95% CI: 63.5% -100%);随机分组后第10天至第31天期间,立即接种聚集群未发现埃博拉病毒病确诊病例,在4个延迟接种聚集群中共发现10例埃博拉病毒病确诊病例。临床试验在接种ERVEBO后,有观察到过敏反应。在服用ERVEBO后发生过敏事件时,必须进行适当的医疗和监督;接种疫苗的个人应继续遵守感染控制措施,以防止扎伊尔埃博拉病毒感染和传播;在接种疫苗者的血液、唾液、尿液和皮肤囊泡液体中检测到疫苗病毒RNA,疫苗病毒传播在理论上是有可能的。
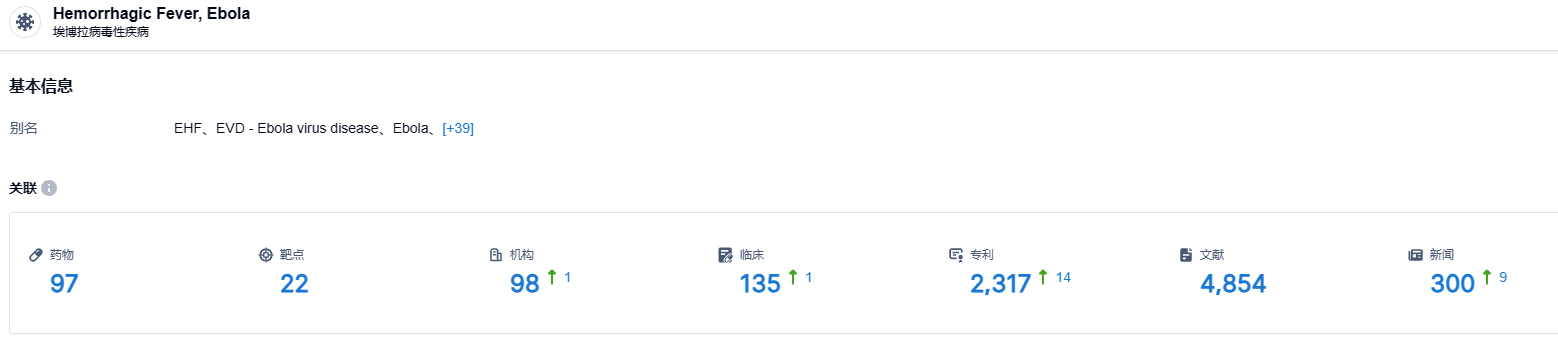
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 埃博拉病毒性疾病 适应症注册登录后可免费获得该适应症下的在研药物、靶点、研发机构、临床试验等详细信息),截止2023年8月5日,埃博拉病毒性疾病 适应症共有在研药物97个,包含的靶点有22种,在研机构98家,涉及相关的临床试验135件,专利多达2317件……ERVEBO在美国扩大使用范围,为防范可能发生的病毒感染提供了更多保障。