凡恩世DLL3/CD47双抗PT217临床试验申请获CDE受理,针对实体瘤
2024年1月24日,专注于肿瘤领域创新药物发现和开发的临床阶段生物技术公司凡恩世制药公司(Phanes Therapeutics, Inc.)宣布,其自主研发的first-in-class双特异性抗体(双抗)PT217临床试验申请已获得CDE正式受理。
PT217是一款具有天然IgG 结构的first-in-class双抗,靶向CD47 + DLL3,是凡恩世自主研发的双抗。PT217可通过巨噬细胞的ADCP活性和NK细胞的ADCC活性直接杀伤肿瘤细胞,并通过同时靶向肿瘤细胞表面过度表达的DLL3和CD47扩大肿瘤杀伤范围。此外,PT217有望通过引导肿瘤细胞进入吞噬性抗原呈递细胞(APCs)来诱导肿瘤新抗原的呈递,并通过识别肿瘤新抗原,间接激活T细胞对低表达或不表达DLL3的肿瘤细胞的杀伤,从而刺激获得性免疫系统。PT217的抗CD47单臂具有高度差异化,并且已经在临床前模型中显示,其在与人红细胞最小程度结合的同时,又保持很强的与肿瘤细胞上CD47的结合活性。在临床前小鼠模型中,PT217显示出强大的肿瘤抑制活性,在NHP模型研究中,PT217也表现出良好的安全性。
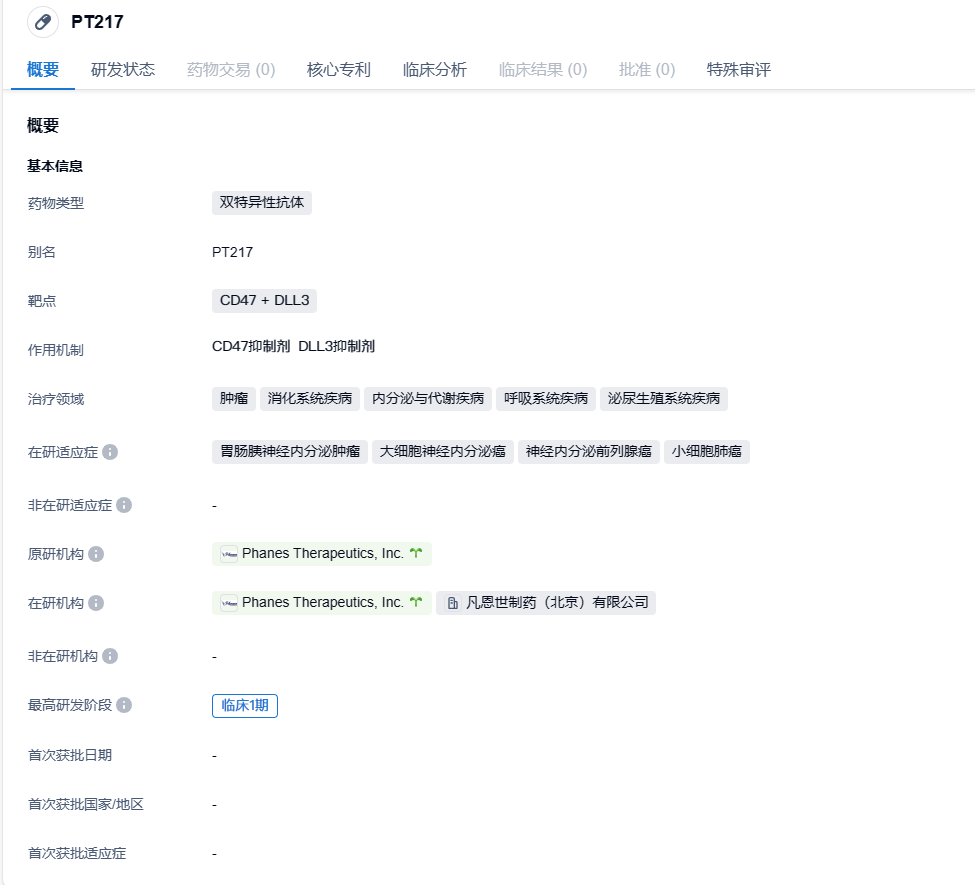
PT217已于2022年获得美国食品药品监督管理局(FDA)批准在美国开展一项多中心临床I期试验(临床登记号NCT05652686),并于2022年获得了FDA授予的孤儿药资格认定,用于治疗小细胞肺癌。PT217的多中心I期临床试验旨在评估PT217在不适合手术切除的小细胞肺癌(SCLC)、大细胞神经内分泌癌(LCNEC)、神经内分泌前列腺癌(NEPC)和胃肠胰腺神经内分泌癌(GEP-NEC)患者中的安全性、耐受性、药代动力学、药效学和初步疗效。这些患者在接受一切可用的标准疗法后出现病程进展,或者标准疗法被证明无效、无法耐受或被认为不合适。
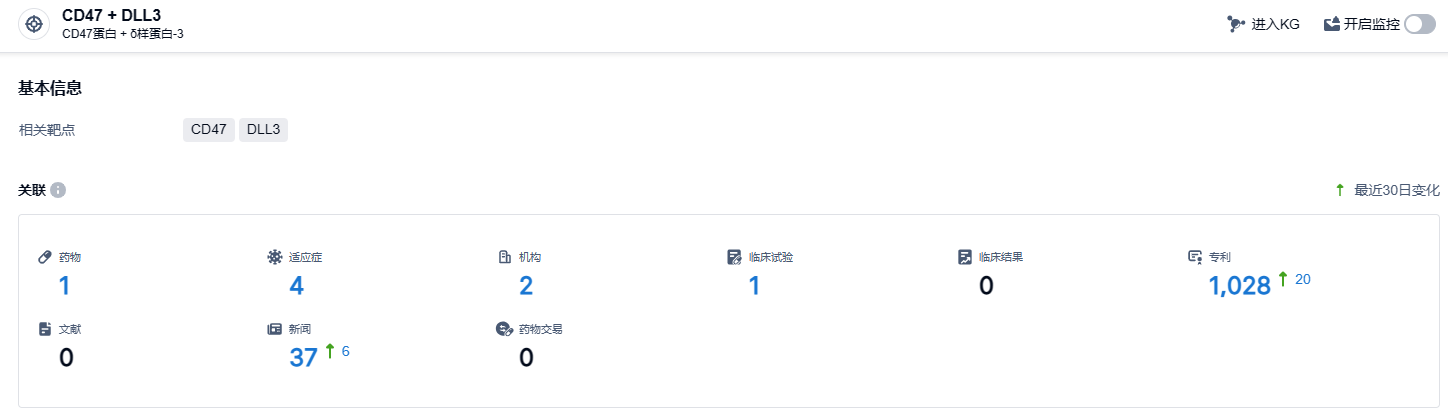
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达CD47 + DLL3靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年1月25日,CD47 + DLL3靶点共有在研药物1个,包含的适应症有4种,在研机构2家,涉及相关的临床试验1件,专利多达1028件……目前凡恩世制药有三个处于临床阶段的项目,包括单克隆抗体PT199,以及两个双特异性抗体项目PT886和PT217。PT886和PT217都已获FDA孤儿药资格认定。期待PT217这款CD47 + DLL3双抗研发顺利。