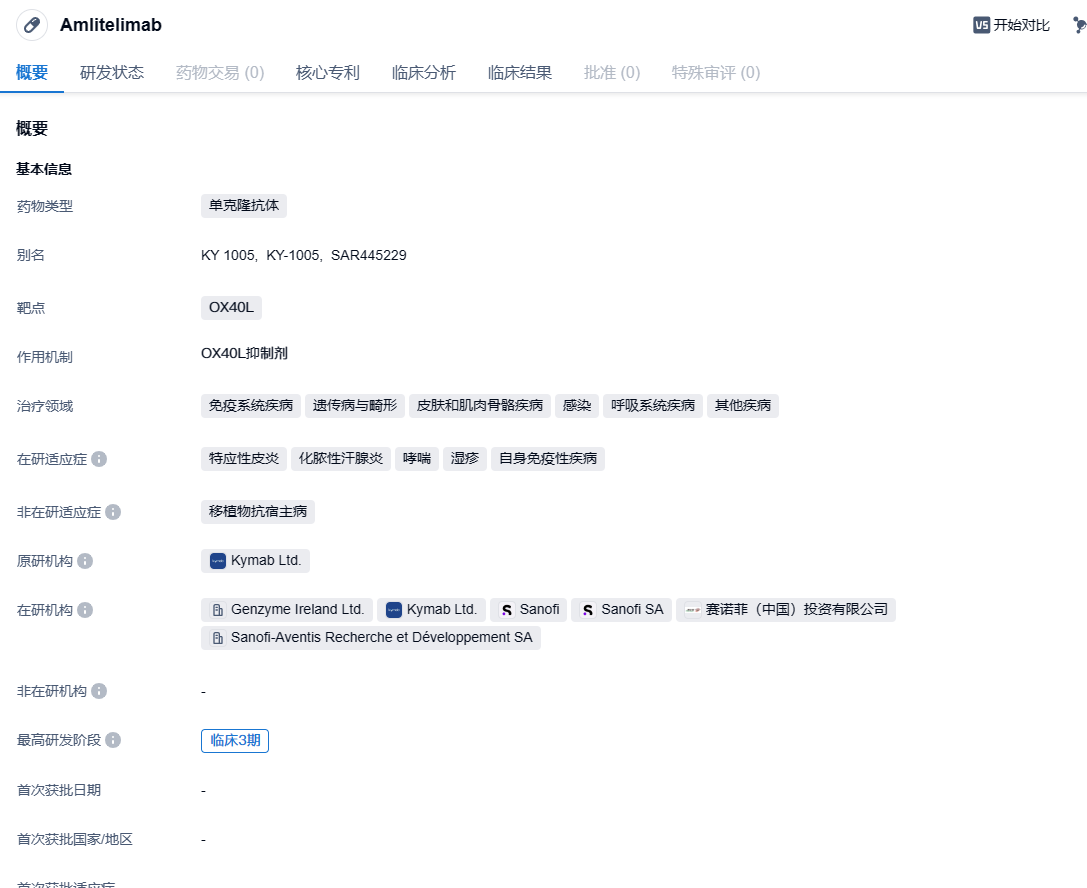
赛诺菲潜在重磅疗法OX40L抗体amlitelimab在中国启动3期临床,治疗特应性皮炎!
2024年4月25日,中国药物临床试验登记与信息公示平台官网最新公示,赛诺菲(Sanofi)已经启动amlitelimab注射液的一项国际多中心(含中国)3期临床研究,旨在评估该产品治疗18岁及以上中重度特应性皮炎患者的疗效和安全性。
amlitelimab是赛诺菲开发的一种全人源性非耗竭性单克隆抗体,可与关键免疫调节剂OX40L结合,旨在恢复促炎T细胞和调节性T细胞之间的免疫稳态。最初该药由Kymab研发,2021年11月,赛诺菲以14.5亿美元的价格收购了Kymab以将该药物收入囊中。2023年6月,赛诺菲(Sanofi)公布其在研靶向OX40-配体单抗amlitelimab在2b期试验STREAM-AD中,达成主要终点,可显著缓解中度到重度特应性皮炎(AD)成人患者的症状,这些患者的疾病无法通过局部药物得到充分控制,或者局部药物并非推荐的治疗方法。2024年1月12日,中国国家药监局药品审评中心(CDE)官网公示,赛诺菲申报的1类新药amlitelimab注射液获得临床试验默示许可,拟开发用于治疗外用处方药控制不佳或不建议使用外用处方药的成年中重度特应性皮炎患者。
此前的临床数据显示,在剂量范围试验中,与安慰剂相比,使用所有四个皮下剂量amlitelimab治疗16周的患者,其平均湿疹面积和严重程度指数(EASI)得分与基线值相较具统计学显著的改善(主要终点)。患者在关键次要终点也有改善,且主要终点和关键次要终点的改善持续存在达24周。此外,生物标志物结果显示amlitelimab可影响2型和非2型炎症途径。安全性方面,在所有的剂量组别中,amlitelimab显示良好的耐受性,且没有发现新的安全问题。
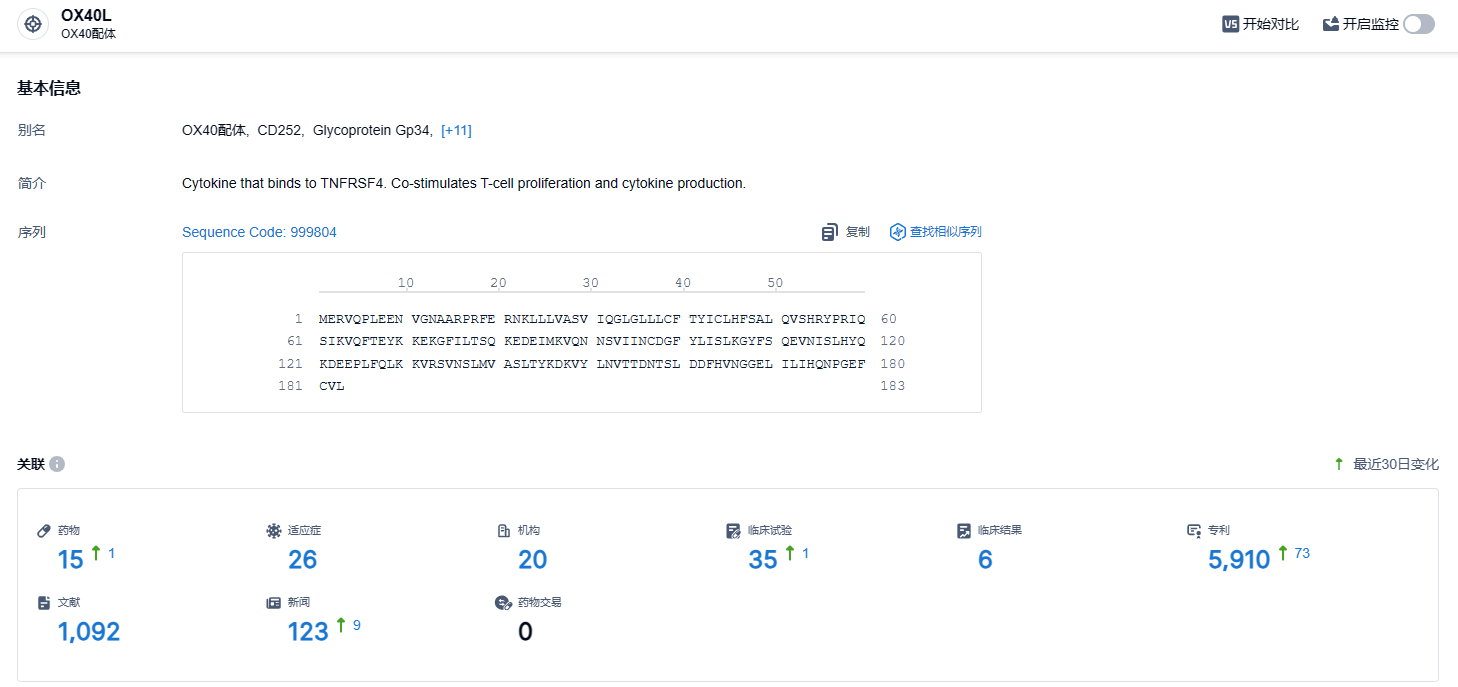
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达OX40L 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年4月27日,OX40L 靶点共有在研药物15个,包含的适应症有26种,在研机构20家,涉及相关的临床试验35件,专利多达5910件……特应性皮炎是最为常见的皮肤疾病之一,全球有超过两亿名患者。高达三分之一成人患者的病情达到中重度,常见症状为皮肤红肿,并伴有持续瘙痒,可能严重影响患者的生活质量。期待amlitelimab能够开发顺利,为广大患者带来新的治疗选择。