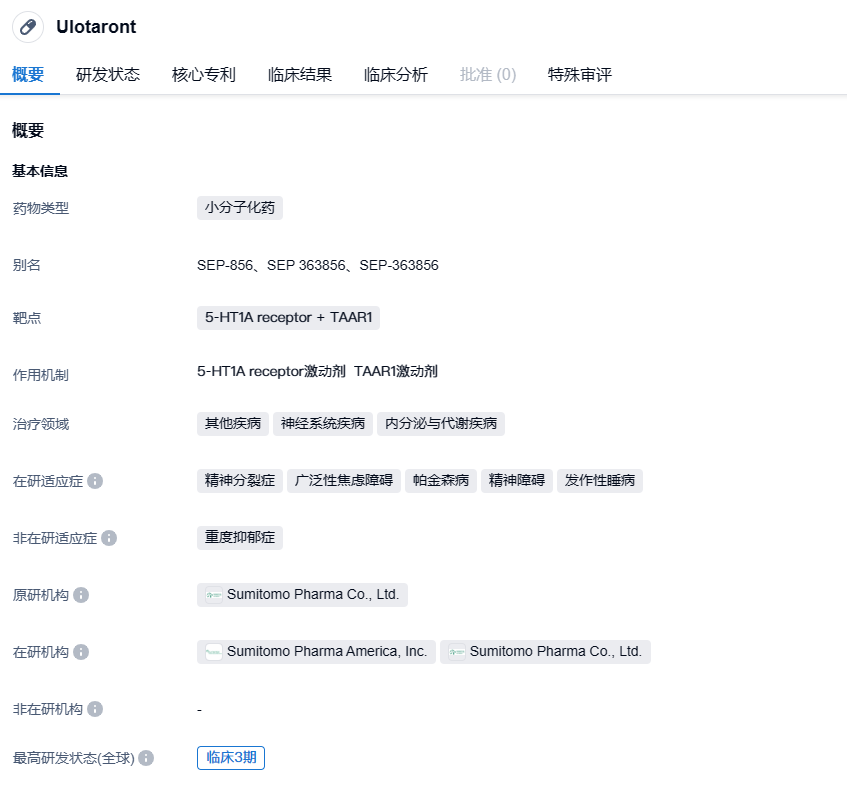
住友制药/大冢制药宣布ulotaront两项III期研究未达到主要终点,治疗精神分裂症
2023 年7月31日,住友制药和大冢制药共同宣布,其在研ulotaront(SEP-363856)治疗急性精神分裂症的两项III期DIAMOND 1和DIAMOND 2研究未达到主要研究终点。
ulotaront是由住友子公司 Sunovion开发的一款微量胺相关受体1(TAAR1)和5-羟色胺1A型(5-HT1A)受体双重激动剂,目前正在开展精神分裂症、广泛性焦虑障碍、重度抑郁症等多项适应症的临床研究,2019年5月其治疗精神分裂症获FDA突破性疗法认定。TAAR是一种G蛋白偶联受体,分布在全身各处,不仅可以被为微量胺激活,也可以被多巴胺或血清素等单胺类物质激活,其中TAAR1是大脑中分布最为广泛的TAAR,并有相关研究显示,部分精神分裂症患者存在TAAR1基因变异。2021 年 9 月,大冢制药花费了近 9 亿美元(2.7 亿美元的预付款和 6.2 亿美元的 Biobucks)购买住友制药的 ulotaront 和其他三款精神疾病候选药物的联合开发和商业化权利。
DIAMOND 1研究是一项随机、双盲、平行分组、固定剂量的多中心III期临床,旨在急性精神分裂症成人患者中评估ulotaront (50mg/天和75mg/天)与安慰剂的疗效、安全性和耐受性,为期6周,共纳入435名受试者。结果显示,3组患者的阳性和阴性症状量表(PANSS)评分均随时间的推移而降低,但在第6周PANSS评分与基线变化的主要终点上,两组均不优于安慰剂(LS均值:ulotaront 50mg/d和75mg/d治疗组分别为-16.9和-19.6,而安慰剂组为-19.3)。DIAMOND 2研究是一项随机、双盲、平行分、固定剂量的多中心III期临床,旨在急性精神分裂症成人患者中评估ulotaront (75mg/d和100mg/d)与安慰剂的疗效、安全性和耐受性,为期6周,共纳入464名受试者。结果显示,与安慰剂相比,ulotaront 75mg/d和100mg/d治疗组在主要终点上没有得到具有统计学意义的改善。第6周时,与安慰剂相比,两组ulotaront治疗组的PANSS评分从基线下降的数值更大(ulotaront 75mg/d和100mg/d治疗组的LS均值分别为-16.4和-18.1,而安慰剂组为-14.3)。
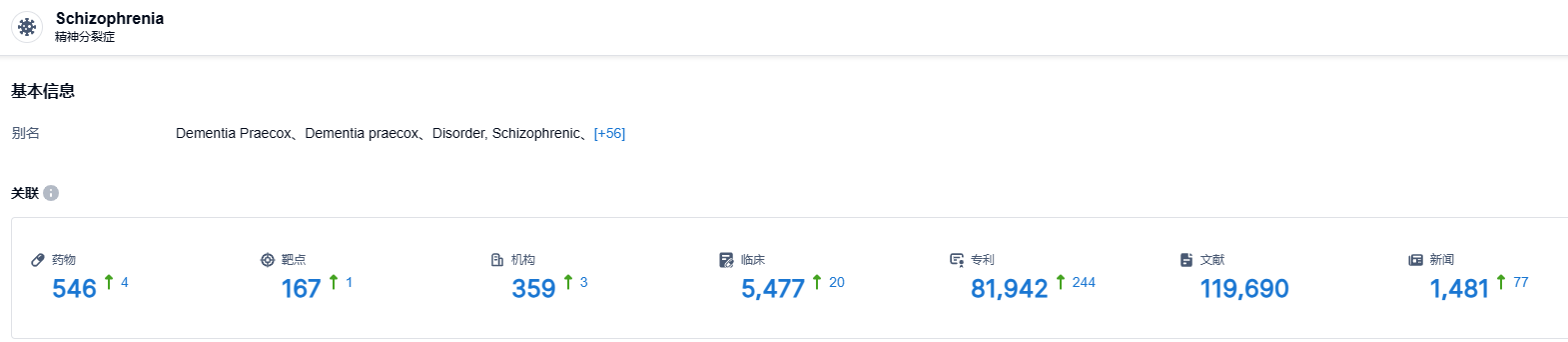
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 精神分裂症 适应症注册登录后可免费获得该适应症下的在研药物、靶点、研发机构、临床试验等详细信息),截止2023年8月2日,精神分裂症 适应症共有在研药物546个,包含的靶点有167种,在研机构359家,涉及相关的临床试验5477件,专利81942件……精神分裂症新药的开发难度大,失败概率高,期待能够有新的有效疗法出现。