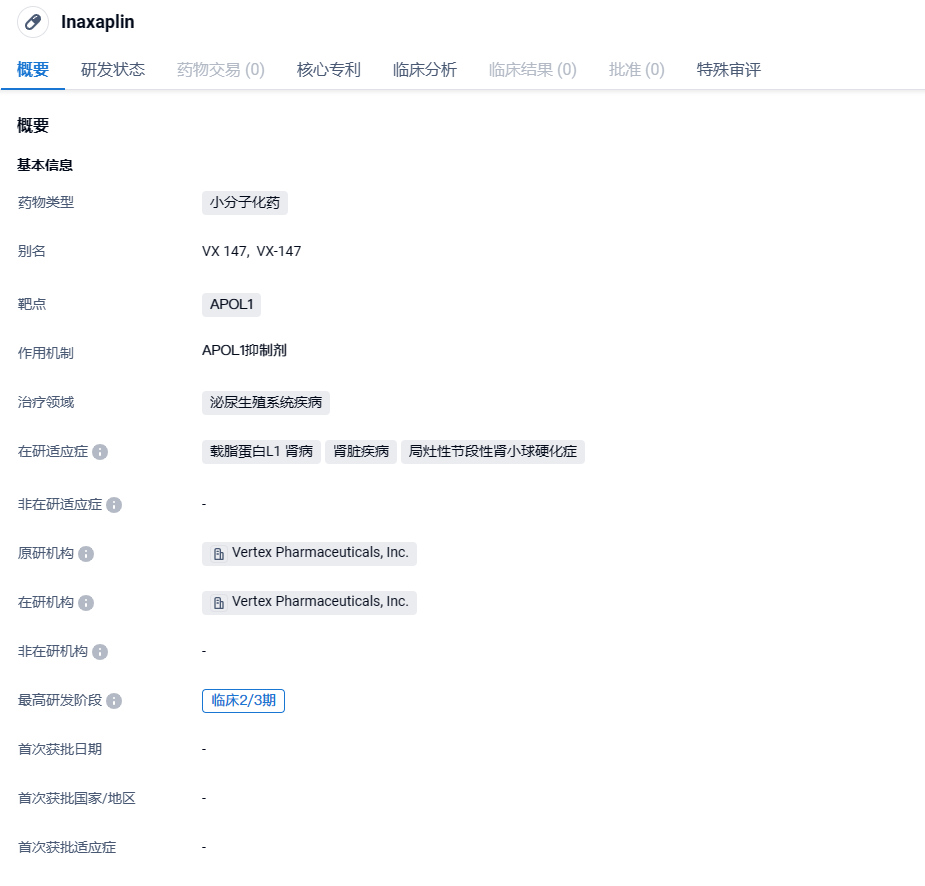
Vertex潜在“first-in-class“小分子APOL1抑制剂挺进3期临床,显著缓解慢性肾病
2024年4月2日,Vertex Pharmaceuticals宣布,潜在“first-in-class”小分子药物inaxaplin(VX-147)已进入关键性2/3期床试验的3期阶段。该试验旨在评估inaxaplin对APOL1介导肾病(AMKD)患者的肾功能和蛋白尿的影响。
Inaxaplin是Vertex Pharmaceuticals开发的一款口服APOL1小分子抑制剂。2022年6月9日,美国FDA已经授予在研疗法Inaxaplin(VX-147)突破性疗法认定,用于治疗APOL1介导的局灶节段性肾小球硬化(FSGS)患者。同时,欧盟药品管理局(EMA)也授予这一在研疗法(PRIME)药品认定,用于治疗APOL1介导的慢性肾病(AMKD)。突破性疗法认定和(PRIME)药品认定的授予都是基于它在治疗FSGS患者的2期临床试验结果。
此前inaxaplin(VX-147)在标准照护下用以治疗APOL1介导肾病(AMKD)的临床前与临床2a期试验积极结果,发表于《新英格兰医学杂志》。公布的试验为一项开放标签临床2a期试验,所有的入组患者带有两个APOL1基因变异,并有经活检证实的FSGS。患者在标准照护下服用每天一次的inaxaplin共13周(15 mg剂量两周与45 mg剂量11周)。试验主要终点为在13周时,患者的尿蛋白肌酐比值(UPCR)与基线相较的百分比变化。
分析显示,纳入分析的13位患者(患者对inaxaplin疗法依从度达80%),其与基线相较的UPCR平均下降百分比为47.6%(95% CI:60-31.3)。无论患者的基线蛋白尿值为何以及接受何种标准照护疗法,数据皆呈现一致性。Inaxaplin在试验中展现良好的耐受性,最常见的不良反应(出现在>15%的患者)为头痛、背痛与恶心。
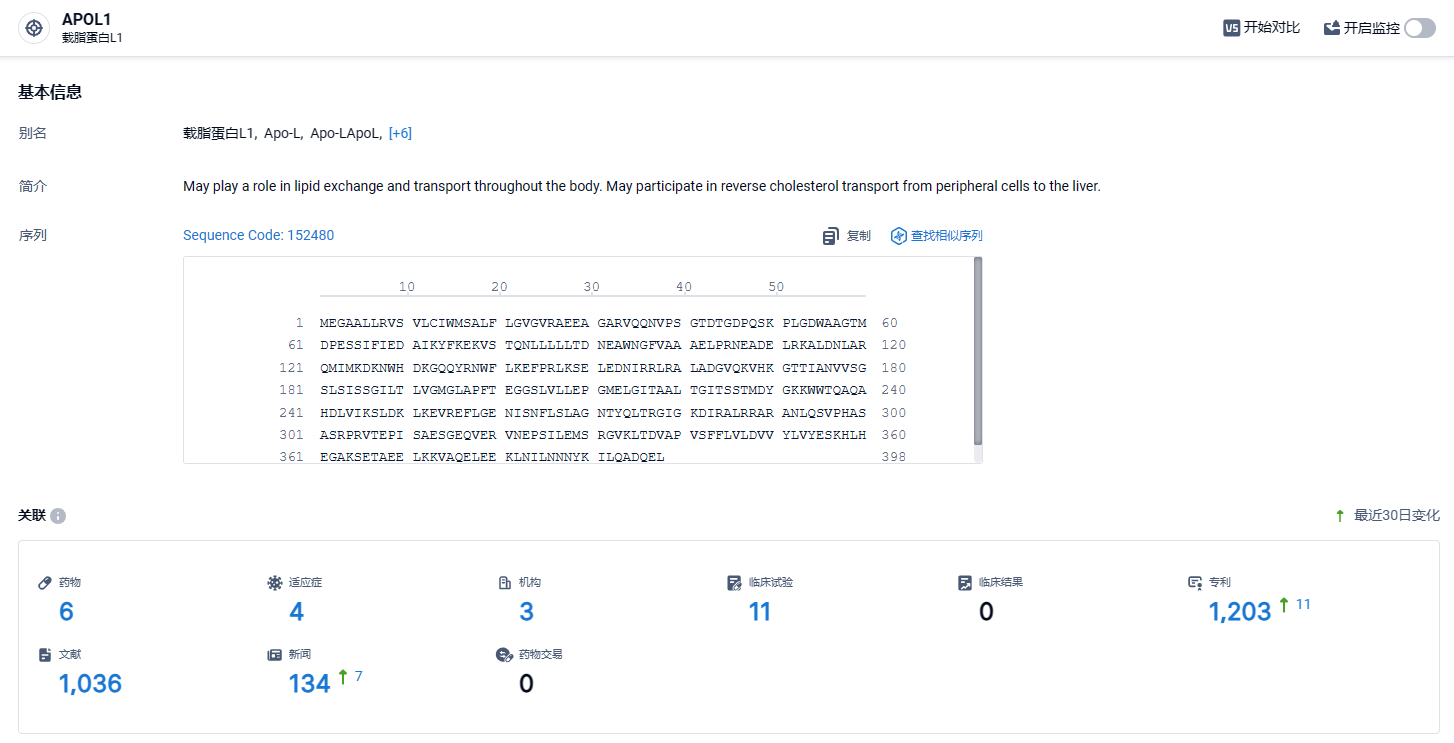
智慧芽新药情报库所披露的信息 (点击下方图片直达 APOL1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年4月3日,APOL1靶点共有在研药物6个,包含的适应症有4种,在研机构3家,涉及相关的临床试验11件,专利多达1203件……APOL1介导性肾病是一种由APOL基因突变引起的。在美国和欧洲影响了大约100000人。遗传功能增益性肾病(gain of function)APOL由基因突变产生的蛋白质会导致足细胞损伤。这种损伤破坏了正常的肾脏过滤功能,导致蛋白尿和肾脏疾病的快速进展。进行性肾脏疾病可导致患者需要接受透析和肾移植治疗,并可能导致死亡。局灶性肾小球硬化APOL一种介导性慢性肾病。期待inaxaplin后续研发顺利,能够早日成功上市,为患者带来新的治疗选择。