卫材/渤健在美递交仑卡奈单抗新适应症上市申请,治疗早期阿尔兹海默病
2024年4月1日,渤健/卫材共同宣布已向FDA递交仑卡奈单抗(Lecanemab,商品名:Leqembi)静脉注射(IV)剂型的补充生物制品许可申请(sBLA),适用于维持治疗早期阿尔茨海默病(AD)患者,即存在轻度认知障碍或处于轻度痴呆阶段的AD患者。
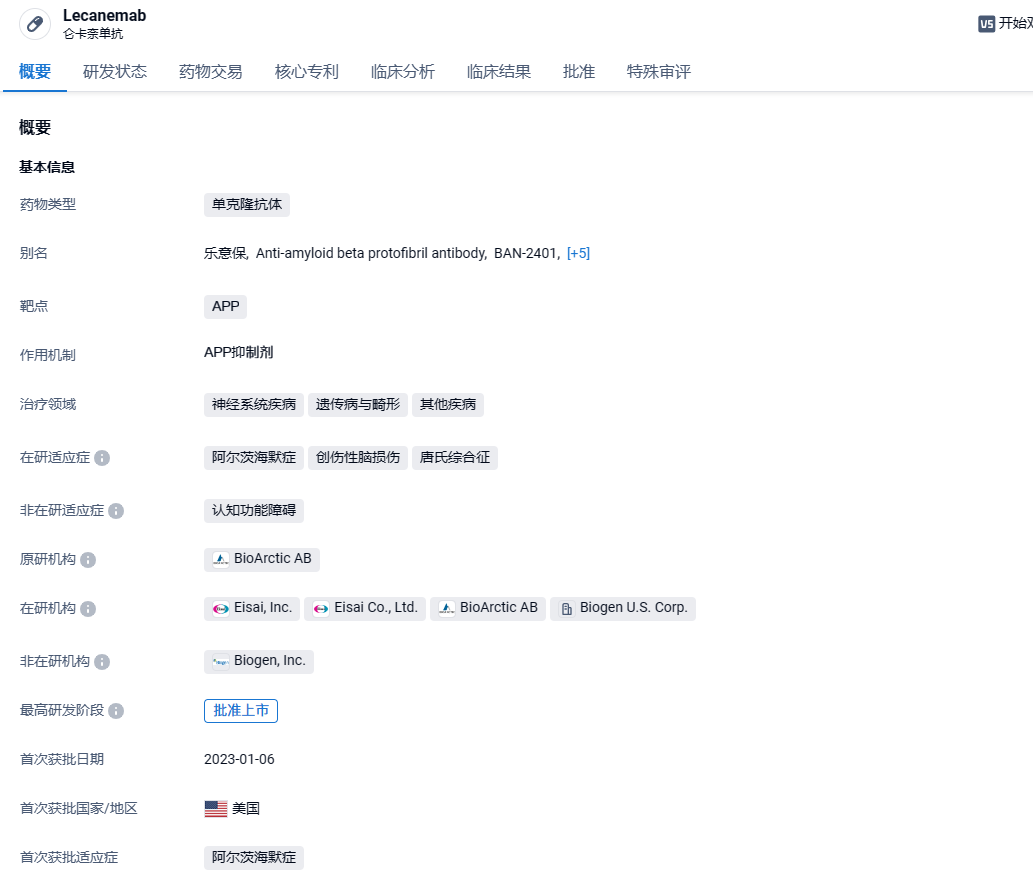
仑卡奈单抗是一种抗β淀粉样蛋白(Aβ)单克隆抗体,能够选择性结合以中和消除可溶性、有毒的淀粉样蛋白-β (Aβ) 聚集体(原纤维),而这些聚集体被认为有助于AD中的神经退行性过程。它是卫材和BioArctic合作研发的成果,由卫材和渤健共同负责该产品用于AD治疗的开发和商业化。
2023年1月6日,基于IIb期概念验证性临床试验 (BAN2401-G000-201) 结果,FDA在加速审批途径下批准了仑卡奈单抗治疗AD的上市申请。不过,只有在轻度认知障碍或轻度痴呆阶段且在病理学上确认存在Aβ的AD患者中才能进行仑卡奈单抗治疗。在仑卡奈单抗获得加速批准的同一天,卫材向FDA提交了寻求仑卡奈单抗全面批准的sBLA(补充生物制品许可申请)。2023年7月6日,FDA官网显示卫材/渤健联合开发的仑卡奈单抗用于治疗阿尔茨海默症(AD)的加速批准已成功转为完全批准。这也意味着仑卡奈单抗成为了20年来首款获得FDA完全批准的AD新疗法。2024年1月9日,中国药监局官网显示,渤健/卫材共同研发的阿尔茨海默病新药仑卡奈单抗(lecanemab-irmb)获批上市,用于轻度阿尔茨海默症(AD)和阿尔茨海默症(AD)引起的轻度认知障碍(MCI)疾病的改善治疗。。
此次sBLA主要是基于II期Study 201研究及其开放标签扩展(OLE)研究和Clarity AD(Study 301)研究及其OLE研究的数据。Clarity AD研究纳入了1795例早期AD患者。研究结果表明,在第18个月时,与安慰剂组相比,仑卡奈单抗组患者的临床痴呆症评分总表(CDR-SB)分数下降了27%。此外,由AD看护者评估的次要终点阿尔茨海默病协作研究组-轻度认知障碍-日常生活能力量表评分(ADCSMCI-ADL,衡量患者独立运作的能力,包括能够穿衣、喂食和参与社区活动)也下降了37%。
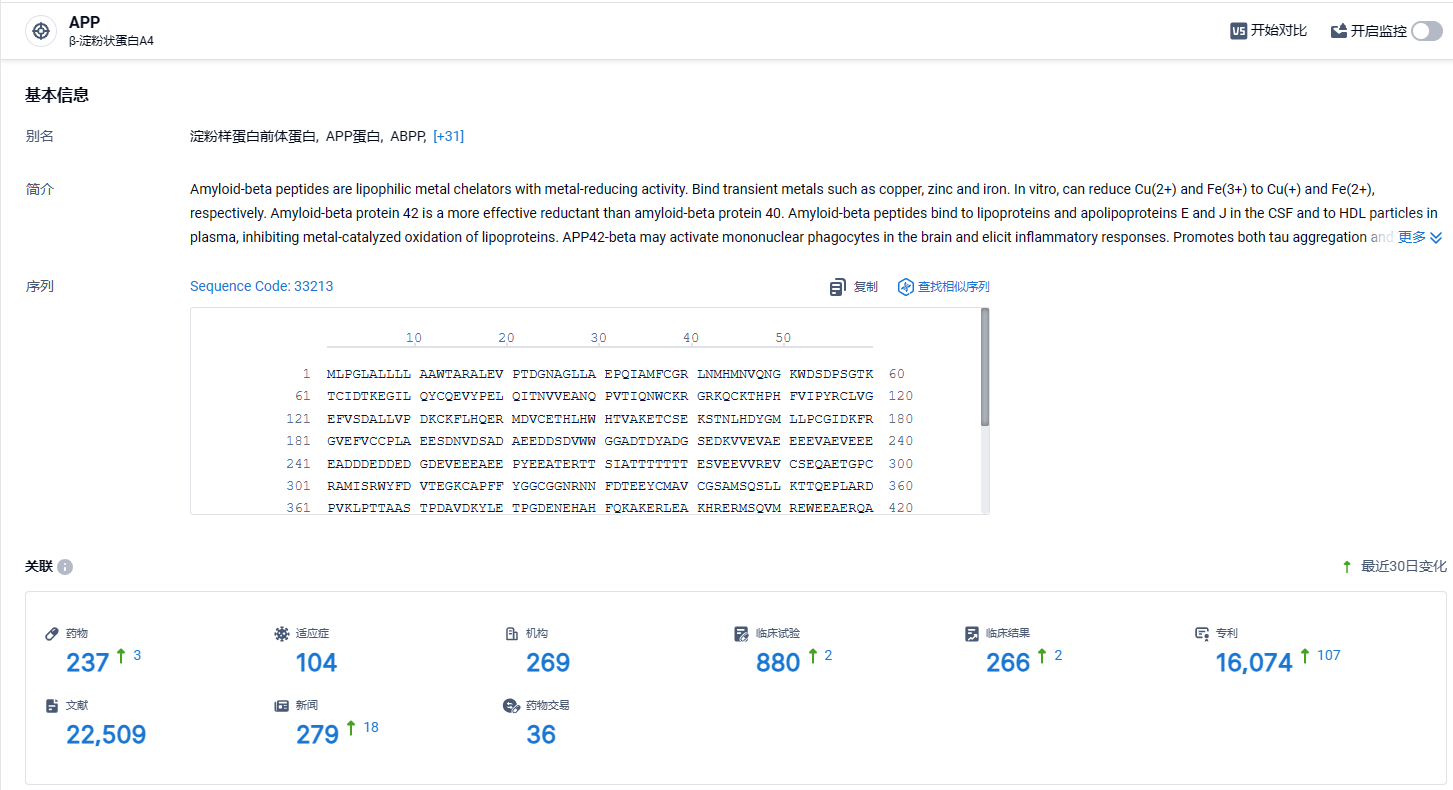
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 APP 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年4月2日,APP靶点共有在研药物237个,包含的适应症有104种,在研机构269家,涉及相关的临床试验880件,专利多达16074件……仑卡奈单抗此次新适应症递交上市,给阿尔茨海默病新药开发增加了信心,期待该领域出现更加优效的新药。