预约演示
更新于:2025-05-07
Ileal Diseases
回肠疾病
更新于:2025-05-07
基本信息
别名 Disease, Ileal、Diseases, Ileal、Ileal Disease + [5] |
简介 Pathological development in the ILEUM including the ILEOCECAL VALVE. |
关联
16
项与 回肠疾病 相关的药物靶点 |
作用机制 α4β7拮抗剂 |
最高研发阶段批准上市 |
首次获批国家/地区 美国 |
首次获批日期2014-05-20 |
靶点 |
作用机制 GLP-1R激动剂 |
在研机构 |
原研机构 |
最高研发阶段批准上市 |
首次获批国家/地区 欧盟 [+3] |
首次获批日期2009-06-30 |
93
项与 回肠疾病 相关的临床试验NCT06916390
Guselkumab Intervention and Diet Evaluation for Pouchitis
Restorative proctocolectomy (RPC) with ileal pouch-anal anastomosis (IPAA) is considered the procedure of choice in patients with ulcerative colitis (UC) refractory to medical therapy or with neoplasia. The most common complication after IPAA is the development of pouchitis. Pouchitis is clinically characterized by variable symptoms including increased stool frequency, altered consistency, bloody stools, abdominal cramping, urgency, and incontinence. Symptomatic pouchitis longer than four weeks is considered chronic pouchitis.
The conventional treatment for acute and chronic pouchitis is antibiotics, such as metronidazole and ciprofloxacin. The disease course of antibiotic responsive pouchitis may evolve into antibiotic dependent (requiring antibiotic maintenance therapy) pouchitis and then antibiotic refractory (no response to antibiotic treatment) pouchitis. Although many patients respond to antibiotic therapy, there is also evidence that suggest that aberrant regulation of the mucosal immune system might play a part in the pathogenesis of pouchitis arising from an abnormal mucosal immune response to a dysbiosis of the pouch microbiota. If individuals fail to respond to antibiotics, anti-tumor necrosis factor (anti-TNF) agents and vedolizumab have been proposed for the treatment of chronic pouchitis.
Guselkumab, an interleukin-23 (IL-23) p19 subunit antagonist monoclonal antibody, is proven to be efficacious in patients with moderately-to-severely active UC. Efficacy of guselkumab in treating UC has been shown in multiple large clinical trials. However, patients with pouchitis were never the targeted population and were even often excluded from the trials.
Pouchitis becomes a chronic problem with a huge impact in the quality of life of these patients. The incidence of pouchitis has been rising in the last decades. This increase might be explained by a change in dietary habits of this population.
This open label single center trial at UZ Leuven aims to evaluate the efficacy and safety of guselkumab in the treatment of chronic antibiotic refractory pouchitis during a 48-week treatment period, with or without a dietary intervention. Twenty subjects with a proctocolectomy and IPAA for UC who have developed chronic or relapsing pouchitis will be enrolled.
The conventional treatment for acute and chronic pouchitis is antibiotics, such as metronidazole and ciprofloxacin. The disease course of antibiotic responsive pouchitis may evolve into antibiotic dependent (requiring antibiotic maintenance therapy) pouchitis and then antibiotic refractory (no response to antibiotic treatment) pouchitis. Although many patients respond to antibiotic therapy, there is also evidence that suggest that aberrant regulation of the mucosal immune system might play a part in the pathogenesis of pouchitis arising from an abnormal mucosal immune response to a dysbiosis of the pouch microbiota. If individuals fail to respond to antibiotics, anti-tumor necrosis factor (anti-TNF) agents and vedolizumab have been proposed for the treatment of chronic pouchitis.
Guselkumab, an interleukin-23 (IL-23) p19 subunit antagonist monoclonal antibody, is proven to be efficacious in patients with moderately-to-severely active UC. Efficacy of guselkumab in treating UC has been shown in multiple large clinical trials. However, patients with pouchitis were never the targeted population and were even often excluded from the trials.
Pouchitis becomes a chronic problem with a huge impact in the quality of life of these patients. The incidence of pouchitis has been rising in the last decades. This increase might be explained by a change in dietary habits of this population.
This open label single center trial at UZ Leuven aims to evaluate the efficacy and safety of guselkumab in the treatment of chronic antibiotic refractory pouchitis during a 48-week treatment period, with or without a dietary intervention. Twenty subjects with a proctocolectomy and IPAA for UC who have developed chronic or relapsing pouchitis will be enrolled.
开始日期2025-09-30 |
申办/合作机构- |
NCT06861140
Untersuchung Des Einflusses Einer Tryptophanreichen Diät Auf Das Therapeutische Potential Von Probiotika Nach Antibiotischer Therapie Bei Chronischer Pouchitis (Try Pro Pouch). Eine Prospektive Randomisierte Kontrollierte Doppelblinde Interventionsstudie
Patients with a pouch frequently suffer from chronic inflammation of the intestinal tract, called pouchitis. Pouchitis is routienly treated with repeated courses of antibiotics and probiotics, which does not stop the inflammation from recurring and exposes the patients to the risk of developing antibiotic -resistant pouchitis. Experimental data suggest that the effectiveness of the antibiotic and probiotic treatment can be prolonged by high consumption of trypotophan, an aminoacid present in everyday food. The Try Pro Pouch study aims to compare the consumption of high amounts of tryptophan against placebo in patients with pouchitis.
开始日期2025-04-01 |
NCT06864403
Mirikizumab in the Treatment of Chronic Inflammatory Conditions of the Pouch
The goal of this clinical trial is to learn if mirikizumab works to treat pouch disorders in adults. The main questions it aims to answer are:
Does mirikizumab reduce symptoms of pouch disorders
Participants will:
Take mirikizumab every 4 weeks for one year Visit the clinic once every month for two months and at the end of the study Keep a diary of their symptoms
Does mirikizumab reduce symptoms of pouch disorders
Participants will:
Take mirikizumab every 4 weeks for one year Visit the clinic once every month for two months and at the end of the study Keep a diary of their symptoms
开始日期2025-04-01 |
申办/合作机构 |
100 项与 回肠疾病 相关的临床结果
登录后查看更多信息
100 项与 回肠疾病 相关的转化医学
登录后查看更多信息
0 项与 回肠疾病 相关的专利(医药)
登录后查看更多信息
5,954
项与 回肠疾病 相关的文献(医药)2025-05-03·Journal of Toxicology and Environmental Health, Part A
Chronic exposure to low-dose MC-LR induces ileal inflammation in mice through the PI3K/AKT/mTOR pathway
Article
作者: Zheng, Shuilin ; Yang, Fei ; Zhan, Chunhua ; Zeng, Wen ; Yang, Yue ; Yang, Mingjie
2025-05-01·Digestive and Liver Disease
Impact of histologic disease activity on long-term outcomes in patients with ileal pouch-anal anastomosis for ulcerative colitis
Article
作者: Piovani, Daniele ; Bezzio, Cristina ; Bonovas, Stefanos ; Spinelli, Antonino ; Repici, Alessandro ; Armuzzi, Alessandro ; Figlioli, Gisella ; Spaggiari, Paola ; Iuzzolino, Martina ; Dal Buono, Arianna ; Gabbiadini, Roberto
2025-04-25·Zhonghua wei chang wai ke za zhi = Chinese journal of gastrointestinal surgery
[Surgical treatment of ulcerative colitis: a 10-year retrospective analysis at a surgical referral center].
Article
作者: Zhou, Y ; Gong, J F ; Waresi, Abudourexiti ; Zhu, F ; Li, S ; Yang, Z R ; Wang, Z Y ; Chen, M F ; Guo, Y Z
67
项与 回肠疾病 相关的新闻(医药)2025-03-21
TREMFYA
®
is the only IL-23i to demonstrate clinical remission and endoscopic response, both at one year, with a fully subcutaneous induction regimen
Supported by data from the GALAXI study, TREMFYA
®
is the only IL-23i to show superiority versus STELARA
®
in all pooled endoscopic endpoints within a double-blinded registrational trial
TREMFYA
®
approval in Crohn’s disease builds upon recent ulcerative colitis FDA approval, marking the fourth indication for this dual-acting IL-23i in the U.S.
HORSHAM, PA, USA I March 20, 2025 I
Johnson & Johnson (NYSE:
JNJ
) today announced that the U.S. Food and Drug Administration (FDA) has approved TREMFYA
®
(guselkumab), the first and only IL-23 inhibitor offering both subcutaneous (SC) and intravenous (IV) induction options, for the treatment of adults with moderately to severely active Crohn’s disease (CD), a chronic inflammatory condition of the gastrointestinal tract.
1
This milestone builds upon the FDA approval of TREMFYA
®
in moderately to severely active ulcerative colitis (UC), one of two main forms of inflammatory bowel disease (IBD),
2
which impacts the lives of nearly three million Americans.
3
TREMFYA
®
is the first and only approved fully-human, dual-acting monoclonal antibody that blocks IL-23 while also binding to CD64, a receptor on cells that produce IL-23. IL-23 is a cytokine secreted by activated monocyte/macrophages and dendritic cells that is known to be a driver of immune-mediated diseases including CD.
4,5,6,7,8
“Despite the progress in the management of Crohn’s disease, many patients experience debilitating symptoms and are in need of new treatment options,” said Remo Panaccione, MD, FRCPC, Professor of Medicine and the Director of the Inflammatory Bowel Disease Unit at the University of Calgary and lead investigator of the Phase 3 GRAVITI study. “The approval of TREMFYA offers an IL-23 inhibitor that has shown robust rates of endoscopic remission with both subcutaneous and intravenous induction regimens. Importantly, the fully subcutaneous regimen offers choice and flexibility for patients and providers that have not been available before.”
This approval is supported by results from multiple rigorous Phase 3 trials evaluating more than 1,300 patients with moderately to severely active CD who failed or were intolerant to conventional therapy (i.e. corticosteroids or immunomodulators) or biologics.
6
The GRAVITI study evaluated TREMFYA
®
SC induction and maintenance therapy versus placebo. Data from the GALAXI clinical program showed TREMFYA
®
was superior to STELARA
®
in all pooled endoscopic endpoints, the only IL-23 inhibitor to achieve this in a double-blinded registrational program. The comprehensive results from these Phase 3 studies demonstrated the robust efficacy of SC or IV TREMFYA
®
in achieving clinical and endoscopic endpoints. Highlights from these pivotal studies showed:
6
“TREMFYA is the first and only IL-23 inhibitor that offers a fully subcutaneous treatment option for moderately to severely active Crohn’s disease. With the approval of TREMFYA, it is now possible to achieve meaningful improvements in clinical and endoscopic outcomes with the flexibility of self-administration from the start,” said Chris Gasink, MD, Vice President, Medical Affairs, Gastroenterology & Autoantibody, Johnson & Johnson Innovative Medicine. “TREMFYA provides people living with Crohn’s disease and their healthcare providers a new treatment option that is supported by data from multiple Phase 3 studies, including pooled analyses showing statistical superiority versus STELARA across four endoscopic or combined clinical and endoscopic endpoints.”
TREMFYA
®
dosing in the treatment of moderately to severely active CD:
6
Johnson & Johnson is committed to supporting access to all its treatments, including offering a patient support program called TREMFYA
®
withMe. For commercially insured patients, adults who are prescribed TREMFYA
®
for CD may be eligible to receive their first induction treatment in as little as 24 hours through TREMFYA
®
withMe.
This approval marks the fourth indication for TREMFYA
®
in the U.S., following moderate-to-severe plaque psoriasis in July 2017, active psoriatic arthritis in July 2020 and moderately to severely active UC in September 2024,
6
underscoring Johnson & Johnson’s long-standing legacy in innovation and commitment to patients living with chronic immune-mediated diseases, including IBD. In November 2024, Johnson & Johnson
submitted
a supplemental Biologics License Application (sBLA) to the FDA seeking approval of a SC induction regimen of TREMFYA
®
for the treatment of adults with moderately to severely active UC, based on results of the Phase 3 ASTRO study.
Editor’s Notes:
a) CD64+ cells are the predominant source of IL-23 in CD. Cells not expressing CD64 may also contribute to IL-23 production but to a lesser extent.
1,3
b) “Only” based on approved selective IL-23 inhibitors for moderately to severely active CD as of March 2025.
6,7,8
c) Based on in vitro studies in an inflammatory monocyte model.
4
d) Moderately to severely active CD was defined as a Crohn’s Disease Activity Index (CDAI) score of ≥220 and a Simple Endoscopic Score for Crohn’s Disease (SES-CD) of ≥6 (or ≥4 for subjects with isolated ileal disease).
6
e) Clinical remission was defined as a CDAI score of <150.
,6
f) Endoscopic response is defined as >50% improvement from baseline in SES-CD score.
6
g) Endoscopic remission was defined as an SES-CD score ≤4 and at least a 2-point reduction from baseline and no subscore greater than 1 in any individual component.
6
h) q4w is defined as every four weeks.
6
i) q8w is defined as every eight weeks.
6
j) Dr. Panaccione is a paid consultant for Johnson & Johnson. He has not been compensated for any media work.
ABOUT THE GRAVITI STUDY (
NCT05197049
)
GRAVITI is a randomized, double-blind, placebo-controlled Phase 3 study to evaluate guselkumab SC induction therapy (400 mg at Weeks 0, 4, and 8) in patients with moderately to severely active Crohn’s disease who experienced an inadequate response or failed to tolerate conventional therapy (i.e., corticosteroids or immunomodulators) or biologic therapy (TNF antagonists or vedolizumab).
10
Patients received guselkumab 400 mg SC q4w (x3) followed by guselkumab 200 mg SC q4w; or guselkumab 400 mg SC q4w (x3) followed by guselkumab 100 mg SC q8w; or placebo. The maintenance doses in GRAVITI (200 mg SC q4w and 100 mg SC q8w) are the same as those evaluated in the Phase 3 GALAXI 2 and GALAXI 3 studies that evaluated the efficacy and safety of IV induction followed by SC maintenance therapy in patients with moderate to severely active Crohn’s disease. Similar to GALAXI, GRAVITI employed a treat-through design, in which patients were randomized to guselkumab at Week 0 and remained on that regimen throughout the study, regardless of clinical response status at the end of induction. Participants randomized to placebo were able to receive guselkumab (400 mg SC q4w x3 ➔ 100 mg SC q8w) if rescue criteria were met at Week 16.
10
ABOUT THE GALAXI PROGRAM (
NCT03466411
)
GALAXI is a randomized, double-blind, placebo-controlled, active-controlled (ustekinumab), global, multicenter Phase 2/3 program designed to evaluate the efficacy and safety of guselkumab in participants with moderately to severely active Crohn’s disease with inadequate response/intolerance to conventional therapies (corticosteroids or immunomodulators) and/or biologics (TNF antagonists or vedolizumab).
11
GALAXI includes a Phase 2 dose-ranging study (GALAXI 1) and two independent, identically designed confirmatory Phase 3 studies (GALAXI 2 and 3).
11
Each GALAXI study employed a treat-through design in which participants remained on the treatment to which they were initially randomized and includes a long-term extension study that will assess clinical, endoscopic, and safety outcomes with guselkumab through a total of five years. Patients received guselkumab 200 mg intravenous induction at Weeks 0, 4 and 8 followed by guselkumab 200 mg subcutaneous maintenance every 4 weeks; or guselkumab 200 mg intravenous induction at Weeks 0, 4 and 8, followed by guselkumab 100 mg subcutaneous maintenance every 8 weeks; or a biologic active control; or placebo. Participants randomized to placebo were able to receive ustekinumab if clinical response was not met at Week 12. Of the 873 individuals pooled across the GALAXI 2 & 3 dataset, 456 (52 percent) had prior history of inadequate response to biologics, 365 (42 percent) were biologic-naïve and 52 (6 percent) were biologic experienced without documented inadequate response or intolerance.
12
The GALAXI 2 and GALAXI 3 studies were the first-ever double-blind registrational head-to-head clinical trials to demonstrate superiority versus ustekinumab in Crohn’s disease, showing guselkumab was superior to ustekinumab in all endoscopic-based endpoints when analyzed with pooled data.
ABOUT CROHN’S DISEASE
Crohn’s disease is one of the two main forms of inflammatory bowel disease, which affects an estimated three million Americans.
3
Crohn’s disease is a chronic inflammatory condition of the gastrointestinal tract with no known cause, but the disease is associated with abnormalities of the immune system that could be triggered by a genetic predisposition, diet, or other environmental factors.
1
Symptoms of Crohn’s disease can vary, but often include abdominal pain and tenderness, frequent diarrhea, rectal bleeding, weight loss, and fever. Currently no cure is available for Crohn’s disease.
3
ABOUT TREMFYA® (guselkumab)
Developed by Johnson & Johnson, TREMFYA
®
is the first approved fully-human, dual-acting monoclonal antibody designed to neutralize inflammation at the cellular source by blocking IL-23 and binding to CD64 (a receptor on cells that produce IL-23). Findings for dual-acting are limited to
in vitro
studies that demonstrate guselkumab binds to CD64, which is expressed on the surface of IL-23 producing cells in an inflammatory monocyte model. The clinical significance of this finding is not known.
TREMFYA
®
is a prescription medicine approved in the U.S. to treat:
TREMFYA
®
is approved in Europe, Canada, Japan, and a number of other countries for the treatment of adults with moderate-to-severe plaque psoriasis and for the treatment of adults with active psoriatic arthritis.
Johnson & Johnson maintains exclusive worldwide marketing rights to TREMFYA
®
. For more information, visit:
www.tremfya.com
.
Please read the full
Prescribing Information
, including
Medication Guide
, for TREMFYA® and discuss any questions that you have with your doctor.
You are encouraged to report negative side effects of prescription drugs to the FDA. Visit
www.fda.gov/medwatch
, or call
1-800-FDA-1088
.
Dosage Forms and Strengths
: TREMFYA
®
is available as 100 mg/mL and 200 mg/2mL for subcutaneous injection and as a 200 mg/20 mL (10 mg/mL) single dose vial for intravenous infusion.
ABOUT STELARA® (ustekinumab)
STELARA
®
(ustekinumab), a human interleukin (IL)-12 and IL-23 antagonist, is a prescription medicine approved in the United States to treat.
13
The Janssen Pharmaceutical Companies of Johnson & Johnson maintain exclusive worldwide marketing rights to STELARA
®
.
Please click to read the full
Prescribing Information
and
Medication Guide
for STELARA® and discuss any questions you have with your doctor.
You are encouraged to report negative side effects of prescription drugs to the FDA. Visit
https://www.fda.gov/medwatch
or call 1-800-FDA-1088.
ABOUT JOHNSON & JOHNSON
At Johnson & Johnson, we believe health is everything. Our strength in healthcare innovation empowers us to build a world where complex diseases are prevented, treated, and cured, where treatments are smarter and less invasive, and solutions are personal. Through our expertise in Innovative Medicine and MedTech, we are uniquely positioned to innovate across the full spectrum of healthcare solutions today to deliver the breakthroughs of tomorrow and profoundly impact health for humanity. Learn more at
https://www.jnj.com/
or at
www.innovativemedicine.jnj.com
.
Follow us at
@JNJInnovMed
.
Janssen Research & Development, LLC, Janssen Scientific Affairs, LLC, Janssen Biotech, Inc., and Janssen-Cilag International NV are Johnson & Johnson companies.
1
Crohn’s & Colitis Foundation. What is Crohn’s disease? Available at:
https://www.crohnscolitisfoundation.org/what-is-crohns-disease/causes
. Accessed February 2025.
2
Crohn’s & Colitis Foundation. What is Crohn’s disease? Available at:
https://www.crohnscolitisfoundation.org/what-is-crohns-disease/causes
. Accessed February 2025.
3
Crohn’s & Colitis Foundation. Overview of Crohn’s disease. Available at:
https://www.crohnscolitisfoundation.org/what-is-crohns-disease/overview
. Accessed March 2025.
4
Atreya R, Abreu MT, Krueger JG, et al. Guselkumab, an IL-23p19 subunit-specific monoclonal antibody, binds CD64+ myeloid cells and potentially neutralizes IL-23 produced from the same cells. Poster presented at: 18th Congress of the European Crohn’s and Colitis Organization (ECCO); March 1-4, 2023; Copenhagen, Denmark. Poster P504.
5
Kreuger JG, Eyerich K, Kuchroo VK. Il-23 past, present, and future: a roadmap to advancing IL-23 science and therapy.
Front Immunol.
2024; 15:1331217. doi:10.3389/fimmu.2024.1331217.
6
TREMFYA
®
[Prescribing Information]. Horsham, PA: Janssen Biotech, Inc.
7
Skyrizi
®
[Prescribing Information]. North Chicago, IL: AbbVie, Inc.
8
Omvoh™ [Prescribing Information]. Indianapolis, IN: Eli Lilly and Company.
9
Panaccione, R, et al. Efficacy and Safety of Subcutaneous Guselkumab Induction Therapy in Patients With Moderately to Severely Active Crohn’s Disease: Results Through Week 48 From the Phase 3 GRAVITI Study. Oral presentation (OP72) at American College of Gastroenterology (ACG) 2024.
10
National Institutes of Health: Clinicaltrials.gov. A study of guselkumab subcutaneous therapy in participants with moderately to severely active Crohn’s disease (GRAVITI). Identifier: NCT05197049. Available at:
https://classic.clinicaltrials.gov/ct2/show/NCT05197049
. Accessed February 2025.
11
National Institutes of Health: Clinicaltrials.gov. A study of the efficacy and safety of guselkumab in participants with moderately to severely active Crohn’s disease (GALAXI). Identifier: NCT03466411. Available at:
https://clinicaltrials.gov/study/NCT03466411
. Accessed February 2025.
12
Danese S, et al. Week 48 efficacy of guselkumab and ustekinumab in Crohn’s disease based on prior response/exposure to biologic therapy: Results from the GALAXI 2 & 3 Phase 3 Studies. Poster presentation (Abstract MP672) at United European Gastroenterology Week (UEGW) 2024. October 2024.
13
STELARA
®
Prescribing information. Available at:
https://www.janssenlabels.com/package-insert/product-monograph/prescribing-information/STELARA-pi.pdf
Accessed March 2025.
SOURCE:
Johnson & Johnson
临床结果临床3期上市批准
2025-02-20
Phase 1a Clinical Results Demonstrate a Favorable Safety Profile and BLT1 Engagement In Healthy Volunteers
Preclinical Data Highlight TP-317’s Anti-Inflammatory, Epithelial Barrier-Protective Effects
ESSEX, CT, USA I February 19, 2025 I
Thetis Pharmaceuticals LLC (“Thetis”), a clinical-stage company developing TP-317, a first-in-class, small molecule drug candidate targeting the BLT1 receptor to treat inflammatory bowel disease (IBD), Crohn’s disease and ulcerative colitis, today announced the presentation of new preclinical and clinical data at the 20
th
Congress of the European Crohn’s and Colitis Organization (ECCO) in Berlin, Germany, February 19-22, 2025.
“These new data further validate TP-317’s unique mechanism of action and its potential as an oral, first-in-class therapy for IBD,” said Gary Mathias, CEO of Thetis Pharmaceuticals. “The preclinical results demonstrate gut barrier protection, inflammation reduction, and pain relief, while our clinical data confirm safety, predictable PK, and BLT1 engagement in humans. We’re excited to advance TP-317 into Phase 1b/2a trials in IBD patients.”
The poster presentations include:
Pharmacokinetics, Pharmacodynamics, Safety, and Efficacy of Oral Resolvin E1-based Therapy in Inflammatory Bowel Disease (IBD): Translating Resolvin E1 Activation of BLT1 in Experimental Models to Healthy Volunteers
Abstract Number: P0627, Abstract Session: Friday, February 21 from 12:40 PM – 1:40 PM CEST (6:40 AM-7:40 AM EST)
This Phase 1a clinical trial evaluated the pharmacokinetics, pharmacodynamics, and safety profile of oral TP-317 in healthy volunteers. Key findings include:
“The data from this first-in-human study provide support for target engagement by TP-317 in humans and establish a strong foundation for further clinical development in ulcerative colitis and Crohn’s disease,” said Silvio Danese, M.D., Ph.D., Gastroenterologist and Professor of Gastroenterology at Vita-Salute San Raffaele University and IRCCS San Raffaele Hospital, Milan. “This compound presents a unique therapeutic profile distinct from and complementary to current IBD therapies.”
TP-317, a Novel BLT1 Agonist Oral Therapy for Inflammatory Bowel Disease, Exhibits Anti-Inflammatory and Epithelial Barrier Protective Efficacy in Murine DSS Colitis and TNF
Δ
ARE
Ileitis
Abstract Number: P0069, Abstract Session: Friday, February 21 from 12:40 PM – 1:40 PM CEST (6:40 AM-7:40 AM EST)
This study assessed the efficacy and mechanism of action of TP-317 in preclinical models of colitis. Key findings include:
“These findings highlight TP-317’s ability to restore gut barrier integrity, suppress inflammation, and alleviate visceral pain, reinforcing its promise as a novel oral therapy for both ileal and colonic forms of IBD,” said Bram Verstockt, M.D., Ph.D., Consultant Gastroenterologist IBD, University Hospitals Leuven, Belgium.
About Thetis Pharmaceuticals
Thetis is a clinical-stage pharmaceutical company focused on developing innovative treatments for chronic inflammatory diseases and cancer. Its lead candidate, TP-317, is a first-in-class oral RvE1 drug candidate that targets the LTB4-BLT1 pathway to mobilize the body’s natural ability to resolve disease and restore immune homeostasis. For more information, please visit
www.thetispharma.com
, and follow us on
LinkedIn
.
SOURCE:
Thetis Pharmaceuticals
临床1期临床结果
2024-09-10
GHENT, Belgium--(
BUSINESS WIRE
)--
MRM Health NV, a clinical-stage biopharmaceutical company developing innovative therapeutics for inflammatory, CNS and metabolic diseases, today announced the appointment of Grégoire Franoux, M.B.A., to the newly created role of Chief Business Officer. Concurrently, the company has strengthened its Board of Directors with the appointment of industry veteran Ron Robison, M.D.
“
We are excited to have Grégoire join our executive team at this pivotal moment for MRM Health, on the cusp of late-stage clinical development for our lead candidate MH002 in ulcerative colitis and pouchitis, from our proprietary CORAL platform designed to harness the full power of the gut microbiome to develop effective and safe therapeutics,” said Sam Possemiers, Ph.D., Chief Executive Officer of MRM Health. “Grégoire’s extensive expertise in corporate development, combined with his strategic acumen, will be crucial as we continue to advance our pipeline and expand our reach.
”
Mr. Franoux will lead the company’s business development and corporate strategy, focusing on forging strategic partnerships and driving growth. He brings 20 years of experience in strategic planning, licensing, business development and corporate finance within the biotechnology sector. He joins MRM Health from Belfius Bank, where he was spearheading Corporate Finance and Capital Markets activities in the Life Sciences sector. Prior to joining Belfius, Gregoire held senior business development positions at Oxurion, Gruenenthal GmbH and Flamel Technologies. He holds an M.S. in Biotechnology from ESIEE Paris, an M.S. in International Finance from IAE Aix-Marseille, and an Executive M.B.A. from INSEAD.
“
It is an exciting time to join the MRM Health team as the company makes important progress advancing next-generation LBPs for inflammatory, CNS and metabolic diseases. I look forward to optimizing the value of MRM’s potentially life-altering therapies and delivering them to patients in need
,” commented Grégoire Franoux.
In addition, MRM Health welcomes Ron Robison, M.D., to its Board of Directors. Ron, who previously served as Vice President at AbbVie, brings over three decades of experience in drug development and commercialization. Ron also served in global senior pharmaceutical R&D leadership roles at several organizations, including Mallinckrodt Medical, Sanofi/Sterling Winthrop, Nycomed, Amersham Health, Abbott and Head of R&D and Chief Medical Officer at Solvay Pharmaceuticals. Ron has overseen the approval of more than 20 new molecular entities worldwide with over ten innovative clinical indications obtained under FDA breakthrough therapy designation. Dr. Robison holds an M.D. from the Oregon Health Sciences University, an M.S. in Medical Informatics/Biomedical Engineering from the University of Utah, and a B.S. from Oregon State University.
MRM Health Chairman Werner Cautreels added, “
We are thrilled to have Ron join our Board. His deep industry knowledge and experience progressing assets through clinical and global regulatory development will be invaluable as we continue to grow and develop potentially transformative therapies.
”
-Ends-
About MRM Health
MRM Health is a clinical-stage biotech developing innovative therapeutics for inflammatory, CNS and metabolic diseases. The Company’s most advanced program MH002 is in preparation for pivotal clinical development in Ulcerative Colitis and/or in the orphan disease indication Pouchitis. MRM Health leverages its proprietary disruptive CORAL
®
technology platform to design microbiome-based biotherapeutics, based on disease-focused specific combinations of 5 to 10 live gut bacteria, and to optimize them for faster onset-of-action and increased potency and robustness. A significant differentiator is the ability to manufacture these consortia as single drug substance in a single standardized, scalable and highly cost-effective process. In addition to the program in Inflammatory Bowel Diseases, MRM Health has ongoing preclinical programs in Parkinson’s Disease and Spondyloarthritis, and partnered programs with IFF in Type 2 Diabetes and NAFLD.
For more information, please visit the website at
www.mrmhealth.com
.
高管变更突破性疗法
分析
对领域进行一次全面的分析。
登录
或
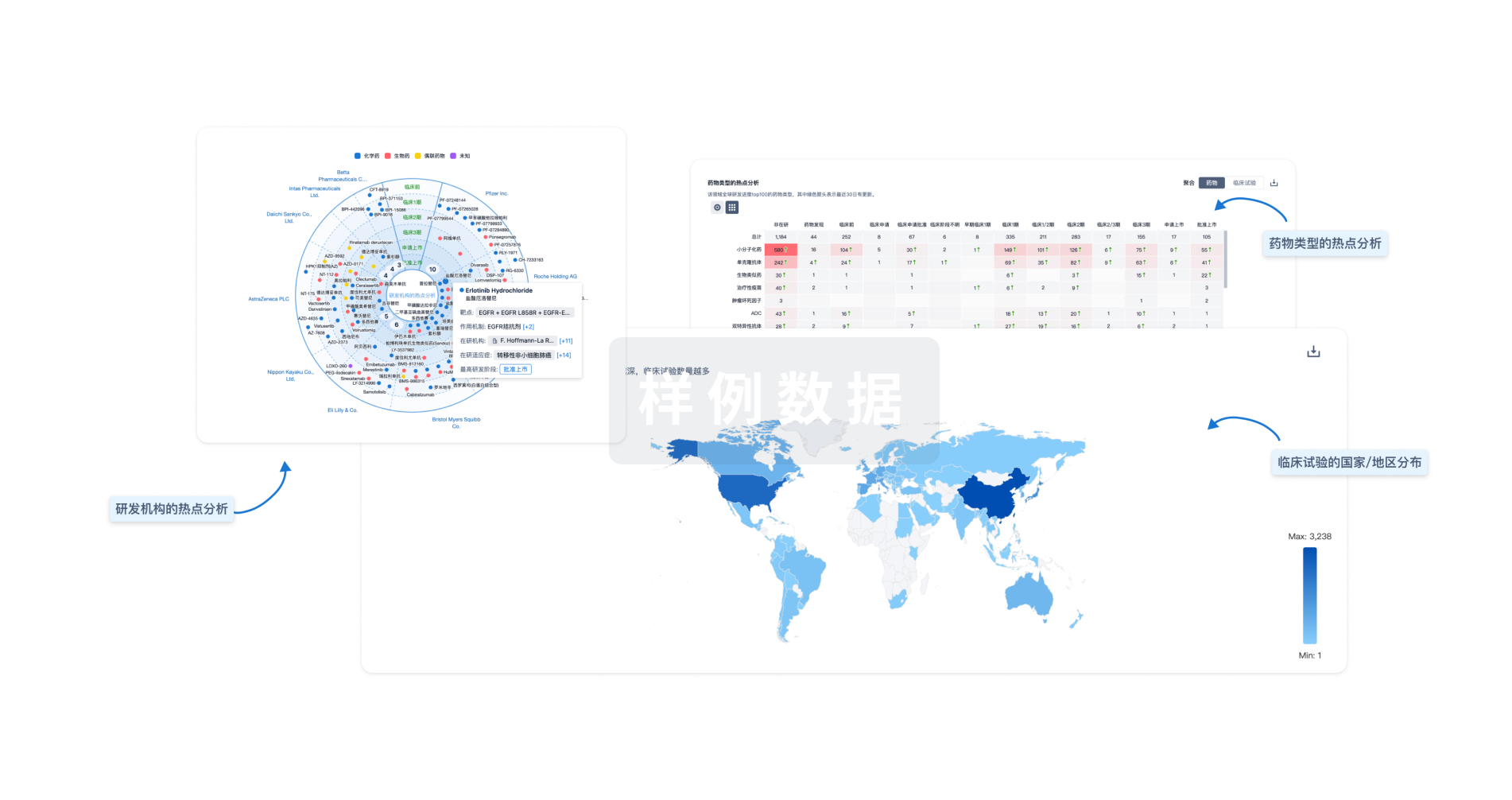
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用





