预约演示
基因治疗递送载体概述
基因疗法信使RNAsiRNA核酸药物寡核苷酸
摘要 :基因递送是将外源DNA转移到宿主细胞的关键过程,常用于基因治疗。随着科学技术的发展,基因治疗因其在多种疾病中的应用前景而成为医学研究的重要领域。然而,缺乏安全高效的基因递送载体仍然是大规模临床应用的主要障碍,设计安全有效的基因递送载体对成功递送外源基因至关重要。目前主要的基因递送载体包括病毒载体和非病毒载体两大类。其中病毒载体包括逆转录病毒、慢病毒、腺病毒和腺相关病毒等,非病毒载体包括以脂质纳米颗粒为代表的合成载体和以细胞外囊泡为代表的生物载体。这些载体各其优缺点,且目前还未找完美的载体,因此基因治疗递送载体尚有广阔的研究前景。
一、基因治疗及其递送载体概述
基因治疗是利用DNA重组技术和基因克隆技术发展起来的最具革命性的医疗技术之一。[1]是将核酸药物或基因编辑装置递送到细胞中持续表达治疗蛋白或纠正细胞错误基因的方法。随着科学、临床和制药等学科的快速发展,基因治疗已经开始用于改善各种癌症和遗传病患者的生活,基因治疗药物产品也获得FDA的大力批准。[2]目前,基因治疗药物包括质粒DNA(plasmid DNA,pDNA)、信使RNA(messenger RNA,mRNA)、微RNA(microRNA,miRNA)、小干扰RNA(small interfering RNA,siRNA)、反义寡核苷酸(antisense oligonucleotide,ASO)和CRISPR/Cas9系统[3]等。
不同的基因治疗机制不同,核酸药物的递送部位和要求也不同。例如,siRNA药物可以在细胞质中作用于mRNA,阻止翻译过程发生,因此,需要将siRNA有效递送到细胞质中发挥作用。而DNA药物一般需要整合到基因组,在细胞核中完成转录以发挥作用,所以 DNA药物需在细胞核及附近释放。然而,核酸药物稳定性低,进入体内后易被血浆和组织中的核酶降解,或被肝脏和肾脏快速清除,又或被免疫细胞吞噬。此外,不同适应证部位还存在阻碍核酸药物进入的天然生理屏障,例如眼部多重保护性屏障和保护中枢神经系统的血脑屏障等。除胞外屏障外,还有细胞膜、内涵体-溶酶体系统和核膜等胞内屏障。因此,用于封装、保护和递送核酸药物的载体对基因治疗的临床应用至关重要。这些递送载体需要克服细胞外和细胞内的屏障、耐受核酶、能增强和协助核酸药物的细胞摄取,且在进入细胞后能促进核酸药物内体逃逸。[4]目前,主要的基因递送载体是病毒载体和非病毒载体。
二、病毒载体
2.1逆转录病毒
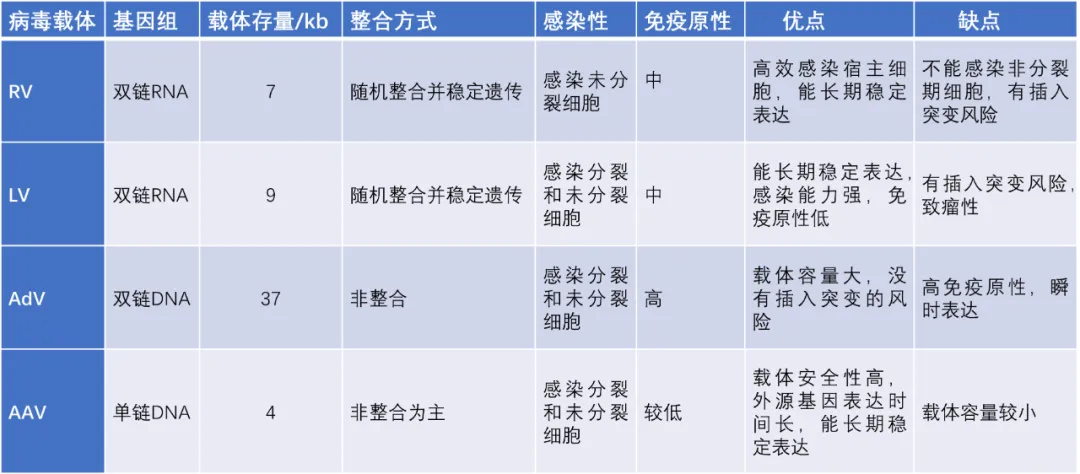
慢病毒(LV)和逆转录病毒(γ-RV)都属于逆转录病毒科,都是不能进行自我复制的RNA病毒。进入宿主细胞后,病毒内逆转录酶将其携带的两个正链RNA反转录成cDNA,进而合成双链DNA,整合酶将双链DNA整合至宿主细胞DNA上。LV因其感染后在出现典型临床症状前潜伏期较长,缓慢发病而得名,已被广泛用于递送基因治疗药物。与其他逆转录病毒相比,慢病毒有更广泛的宿主,且携带并整合进入宿主细胞的目的基因对基因沉默有一定抵抗力,可以在靶细胞中高效稳定表达。[5]在整合宿主基因组过程中,γ-RV通常约 20%的感染事件发生在转录单位的5'端,对CpG岛和DNase I超敏感位点附近有一定的倾向性。而LV多整合到远离转录起始点的位点。因此,与γ-RV相比,LV致癌可能性较低,临床应用可能更安全。逆转录病毒也具有局限性,其作为基因药物的递送载体,宿主基因组的整合可能导致不必要的非靶点插入突变,从而带来安全风险。
2.2腺病毒(AdV)
AdV是一种无包膜的双链DNA病毒,具有二十面体衣壳结构,迄今为止,已经发现了大约50种血清型。它们感染广泛的脊椎动物宿主,人类腺病毒感染常发生在上呼吸道,引起普通感冒、结膜炎和扁桃体炎等症状。[6]AdV装载容量巨大,可搭载锌指核酸酶(ZFN)、转录激活物样效应因子核酸酶(TALEN)和簇状规则间隔的短回文重复序列及其相关蛋白(CRISPER/Cas)等基因编辑工具。[4]同时,腺病毒感染宿主细胞范围广,在不同类型的非分裂和分裂细胞中都具有较高的转导效率。此外,它不需要整合到宿主细胞基因组中,且在体内具有较低的遗传毒性。[7]由于AdV具有感染宿主范围广、易纯化、遗传稳定性好、外源基因载量大等特点而被广泛应用于临床治疗中。目前临床治疗中使用的病毒载体中约有25%是AdV载体。[2]然而,AdV被当作疫苗载体使用时,存在预先存在免疫力而降低疫苗的有效性的问题。且因其具有高免疫原性、细胞毒性及瞬时转基因表达等问题,使AdV载体研究充满了挑战。
2.3腺相关病毒(AAV)
AAV是一种非致病性的无包膜病毒,具有单链DNA,因最初被发现是腺病毒制剂的污染物而得名。[8] AAV有12个自然血清型和130多个变种,不同的血清型有不同的结合受体和组织趋向性,可通过选择合适的血清型将基因输送到特定的组织。[9]AAV具有低免疫原性、低基因毒性、衣壳蛋白多样性、作用时间长和易于生产等特点,在临床上引用广泛。[4]但AAV递送系统只能包装和递送小于4.7 kb的基因片段,较长的基因片段会导致低载体产量和无效包装。而且AAV生产工艺复杂,成本高,在基因治疗研究中,为尽可能减少细胞毒性,提高治疗效率,需要探索AAV载体介导的基因治疗的最优靶向策略,目前主要通过基因改造、转录水平的靶向调控和衣壳蛋白的共价偶联修饰三种方式进行优化。[2]同时,有研究结果显示AAV临床实验中存在载体的整合性和肝脏毒性等安全问题,以及潜在的致瘤性、血栓性微血管病和神经毒性风险。[10]
表1 四种不同病毒载体的比较[4]
Preview
来源: 药精通Bio
三、非病毒载体
相比于病毒载体,非病毒载体具有生物相容性好、可生物降解、装载容量大、成本低、易于生产制造等优势,且由于低毒性和低免疫原性被认为是病毒载体的安全的替代品,具有基因治疗应用潜力。非病毒载体包括以脂质纳米颗粒 (lipid nanoparticle,LNP)为代表的合成载体和以细胞外囊泡为代表的生物载体。
3.1脂质纳米颗粒(LNP)
LNP由磷脂、胆固醇、聚乙二醇化脂质和阳离子或可电离脂质的混合物组成,是目前研究较广泛的非病毒载体。[2]磷脂分子包裹脂溶性或水溶性药物,通过与细胞膜融合将药物输送到体内。相比于其他合成载体,LNP 具有更好的生物相容性、固有的膜穿透能力、生物降解性、结构灵活性和低免疫原性。[11]LNP已广泛应用于基因治疗药物的递送,目前已有三款基于LNP-RNA的疗法获得FDA比准,分别是治疗转甲状腺素蛋白淀粉样变性(ATTR)的Patisiran,通过静脉注射向肝细胞递送小干扰RNA(siRNA),以及两款新冠mRNA疫苗。然而,阳离子脂质可与多种蛋白质、脂蛋白相互作用,导致RNA聚集体的形成或药物突释,从而造成系统毒性。[4]此外,静脉注射后的血清蛋白可吸附在LNP表面,导致LNP在肝脏中自然积蓄。[12]因此为提高基因治疗药物的递送效率以及安全性,需要对LNP进行巧妙设计。除此之外,合成载体还有无机纳米粒子(INP)、聚合物纳米粒子(PNP)等。
3.2细胞外囊泡
细胞外囊泡是外泌体、微囊泡和凋亡小体的总称,是细胞分泌的磷脂双层囊泡,能包裹各种生物分子,如蛋白质、脂质、DNA和RNA等,并将其从供体细胞转运至受体细胞,从而改变受体细胞的生理机能。[4]细胞外囊泡的靶向特性由其脂质组成和蛋白质含量决定。[13]其来源和给药途径可显著影响药物的生物分布,且可通过修饰技术提高靶向效率。细胞外囊泡作为一种内源性的囊泡,具有较低的免疫原性,作为基因治疗载体是具有一定的安全性的。但是也有研究表明,囊泡与脂质体给药方式类似,静脉注射会导致其非特异性累积。同时囊泡固有的复杂性、尺寸异质性和批间差异,使起临床转化具有很大的挑战。[4]
四、展望
理想的基因载体应具备靶向性、稳定性、易制备、可浓缩和纯化、无毒或低毒性、有利于基因的高效转移和长期表达、容量合适且缺乏自动复制载体的能力。[2]目前各类载体都各有优劣。开发新的基因药物载体的研发之路还在继续。我们相信,随着研究继续进行,基因治疗对未来疾病的治疗会产生重大影响。
【参考文献】
[1] PAN X, VERONIAINA H, SU N, et al. Applications and developments of gene therapy drug delivery systems for genetic diseases [J]. Asian Journal of Pharmaceutical Sciences, 2021, 16(06): 687-703.
[2] MA C-C, WANG Z-L, XU T, et al. The approved gene therapy drugs worldwide: from 1998 to 2019 [J]. Biotechnology advances, 2020, 40: 107502.
[3] MADIGAN V, ZHANG F, DAHLMAN J E. Drug delivery systems for CRISPR-based genome editors [J]. Nature Reviews Drug Discovery, 2023, 22(11): 875-94.
[4] 李嫚琪, 魏丽萍, 陶巧玉, 等. 基因治疗递送载体应用现状及安全性研究进展 [J]. 中国医药工业杂志, 2022, 53(12): 1671-82.
[5] MENG F, CHEN C, WAN H, et al. [Advances of lentiviral vectors] [J]. Zhongguo Fei Ai Za Zhi, 2014, 17(12): 870-6.
[6] CHANG J. Adenovirus vectors: excellent tools for vaccine development [J]. Immune network, 2021, 21(1).
[7] CRENSHAW B J, JONES L B, BELL C R, et al. Perspective on adenoviruses: epidemiology, pathogenicity, and gene therapy [J]. Biomedicines, 2019, 7(3): 61.
[8] NASO M F, TOMKOWICZ B, PERRY III W L,et al. Adeno-associated virus (AAV) as a vector for gene therapy [J]. BioDrugs, 2017, 31(4): 317-34.
[9] LI C, SAMULSKI R J. Engineering adeno-associated virus vectors for gene therapy [J]. Nature Reviews Genetics, 2020, 21(4): 255-72.
[10] HINDERER C, KATZ N, BUZA E L, et al. Severe toxicity in nonhuman primates and piglets following high-dose intravenous administration of an adeno-associated virus vector expressing human SMN [J]. Human gene therapy, 2018, 29(3): 285-98.
[11] YONEZAWA S, KOIDE H, ASAI T. Recent advances in siRNA delivery mediated by lipid-based nanoparticles [J]. Advanced drug delivery reviews, 2020, 154: 64-78.
[12] KARA G, CALIN G A, OZPOLAT B. RNAi-based therapeutics and tumor targeted delivery in cancer [J]. Advanced Drug Delivery Reviews, 2022, 182: 114113.
[13] MURPHY D E, DE JONG O G, BROUWER M, et al. Extracellular vesicle-based therapeutics: natural versus engineered targeting and trafficking [J]. Experimental & molecular medicine, 2019, 51(3): 1-12.
内容来源于网络,如有侵权,请联系删除。
机构
-靶点
-生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。


