2023 ACR | 荣昌生物口头报告泰它西普治疗类风湿关节炎的3期临床数据
近日,荣昌生物在美国风湿病学会(ACR)2023年会现场,以口头报告形式公布了BLyS/APRIL抑制剂泰它西普治疗类风湿关节炎(RA)患者的3期临床试验结果。数据显示,该研究达到所有主要终点,并显示出良好的安全性。
泰它西普是由荣昌生物自主研发的用于治疗自免疾病的新型融合蛋白,由人跨膜激活剂及钙调亲环素配体相互作用因子(TACI)受体的胞外域以及人免疫球蛋白G(IgG)的可结晶片段(Fc)域构成。泰它西普能够同时抑制APRIL + BAFF,得以有效降低 B 细胞介导的自身免疫应答,自身免疫应答与多种自身免疫性疾病有关。2021年3月9日,中国NMPA批准泰它西普附条件上市,用于治疗活动性、自身抗体阳性系统性红斑狼疮(SLE)的成人患者。2022年10月,泰它西普获美国FDA颁发的针对重症肌无力治疗的孤儿药资格认定。目前泰它西普SLE适应症正在美国开展3期临床试验,预计2024年前完成。2023年9月7日,荣昌生物注射用泰它西普的新适应症上市申请获CDE受理,用于治疗类风湿性关节炎(RA)。这是泰它西普继2021年3月获批系统性红斑狼疮适应症后,申报上市的第二项适应症。
此次荣昌生物在ACR年会报告的是一项随机、双盲、安慰剂对照、多中心的3期临床研究,旨在评估160mg泰它西普与安慰剂在对甲氨蝶呤(MTX)反应不足的RA患者中的疗效和安全性。研究共入组479例类风湿关节炎患者,主要疗效终点是在第24周达到ACR20应答的患者比例。次要疗效终点包括ACR50和ACR70应答率,ACR应答的各个组成部分,DAS28-ESR以及在第24周通过mTSS测量的放射学关节损伤。数据显示,此项3期临床试验达到主要临床终点和次要终点。研究结果证明了泰它西普在治疗对MTX反应不足的中重度类风湿关节炎患者的疗效和安全性。24周时,与安慰剂组相比,泰它西普组ACR20应答率显著增加(60.0% vs 26.9%)。在第24周,泰它西普组的ACR50应答率显著高于安慰剂组(21.4%vs.5.9%),并且在DAS28-ESR较基线降低以及ACR应答标准的各个组成部分方面,均显著优于安慰剂组。
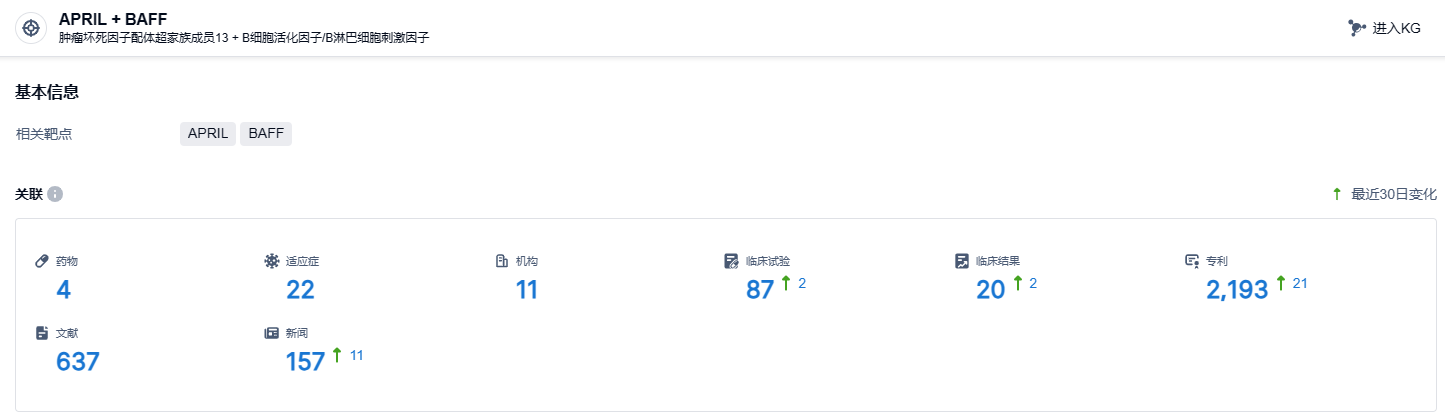
根据智慧芽新药情报库所披露的信息 (点击下方图片直达APRIL + BAFF靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月21日,APRIL + BAFF靶点共有在研药物4个,包含的适应症有22种,在研机构11家,涉及相关的临床试验85件,专利多达2131件……除SLE和RA之外,泰它西普用于治疗IgA肾病、视神经脊髓炎谱系疾病、原发性干燥综合征、重症肌无力、多发性硬化等适应症的Ⅲ期临床研究正在进行,展示了其在B细胞相关疾病治疗中的广泛前景。期待泰它西普类风湿关节炎新适应症早日获批上市,将有望给国内RA患者带来新的治疗选择。