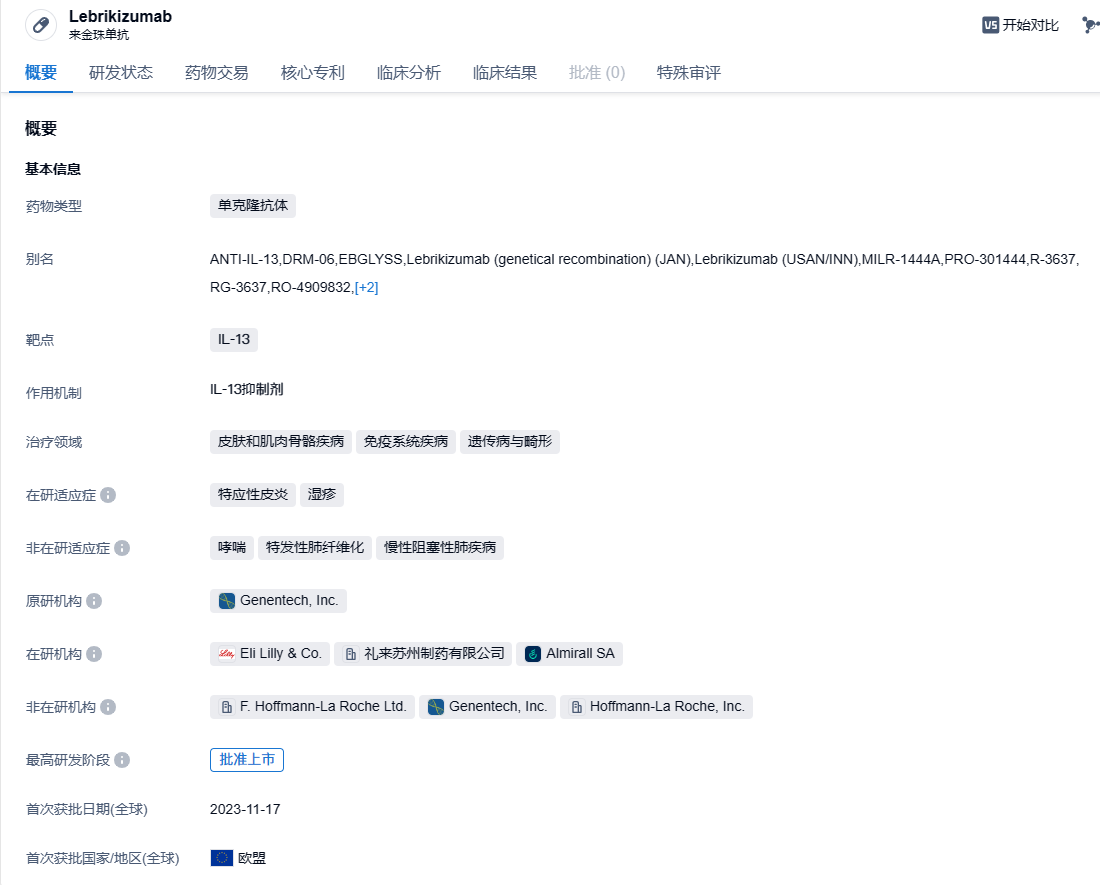
全球首批!Almirall/礼来IL-13单抗Lebrikizumab成功在欧洲获批,治疗特应性皮炎
近日,Almirall公司宣布,与礼来公司联合开发的IL-13特异性抗体疗法Ebglyss(lebrikizumab)已经获得欧盟委员会批准上市,用于治疗中度至重度特应性皮炎(AD)成年和青少年患者(12岁及以上,体重至少40公斤),这些患者需要接受全身性治疗。
Lebrikizumab是一种新型的抗IL-13单克隆抗体,具有生物利用度高和半衰期长的特点,能够高亲和力结合可溶性IL-13,阻断IL-13介导的信号通路。此前,Lebrikizumab曾获得FDA的快速通道资格。Lebrikizumab最初由Tanox开发,名称为TNX-650;2007年Genentech(罗氏子公司)收购Tanox,Lebrikizumab成为了罗氏管线中的一员。 紧接着,2017年Dermira支付罗氏8000万美元首付款、14亿美元里程碑总额,获得Lebrikizumab全球权益。2019年6月,该药的欧洲权益又被出售给Almirall。2020年1月,礼来以总价11亿美元收购了Dermira,Lebrikizumab欧洲以外的全球权益落入礼来手中。
Lebrikizumab的批准基于三项关键性3期临床试验:ADvocate 1和ADvocate 2评估其作为单药治疗的效果,ADhere评估其与外用皮质类固醇(TCS)联用的效果。在第16周,lebrikizumab作为单药治疗展示了早期临床疗效,超过50%的患者实现了疾病程度和严重性至少下降75%(EASI-75)。与TCS联用时,这一有效性提高到了近70%的患者。值得注意的是,长期扩展试验结果显示,在第16周获得缓解并继续接受lebrikizumab治疗的患者,无论是接受单药治疗还是与TCS联用,几乎80%的患者可在长达两年的时间内持续保持皮肤清洁、止痒和疾病严重程度减轻。这些研究中的安全性评估显示,大多数不良事件(AE)严重程度为轻微或中等,并未导致治疗中断。最常见的不良反应包括结膜炎、注射部位反应、和干眼症。
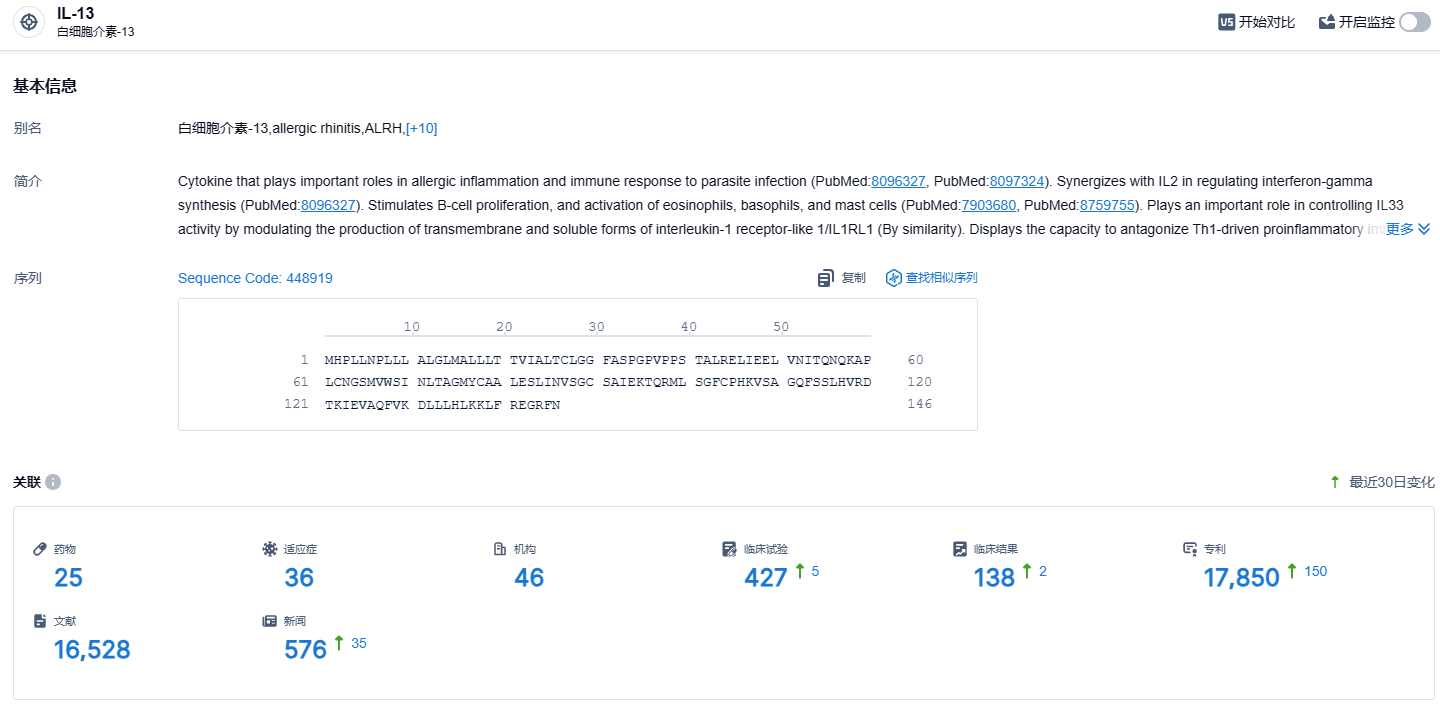
根据智慧芽新药情报库所披露的信息 (点击下方图片直达IL-13靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月21日,IL-13 靶点共有在研药物25个,包含的适应症有36种,在研机构46家,涉及相关的临床试验427件,专利多达17850件……今年10月2日,FDA宣布拒绝批准礼来用于治疗中度至重度特应性皮炎(湿疹)的Lebrikizumab生物许可申请(BLA),主要原因是在检查中发现了第三方合同生产组织(CMO)的问题。 来自FDA的CRL中没有提到对Lebrikizumab的临床数据、安全性或标签的担忧,因此,如果CMO问题可以有效解决,或者生产转移到新的合作伙伴,等待批准时间或许不用太久。期待Lebrikizumab能够早日在美国获批。