第74届AASLD年会 | 翰森制药乙肝新药艾米替诺福韦3期临床144周数据发表
2023年11月16日,翰森制药发布新闻稿称,其在研口服抗乙肝病毒创新药艾米替诺福韦(TMF)的3期临床研究144周数据,在第74届美国肝病研究学会(AASLD)年会上以“最新突破摘要(LBA)”形式发布,研究结果再次验证了艾米替诺福韦长期治疗慢乙肝患者的疗效和安全性。
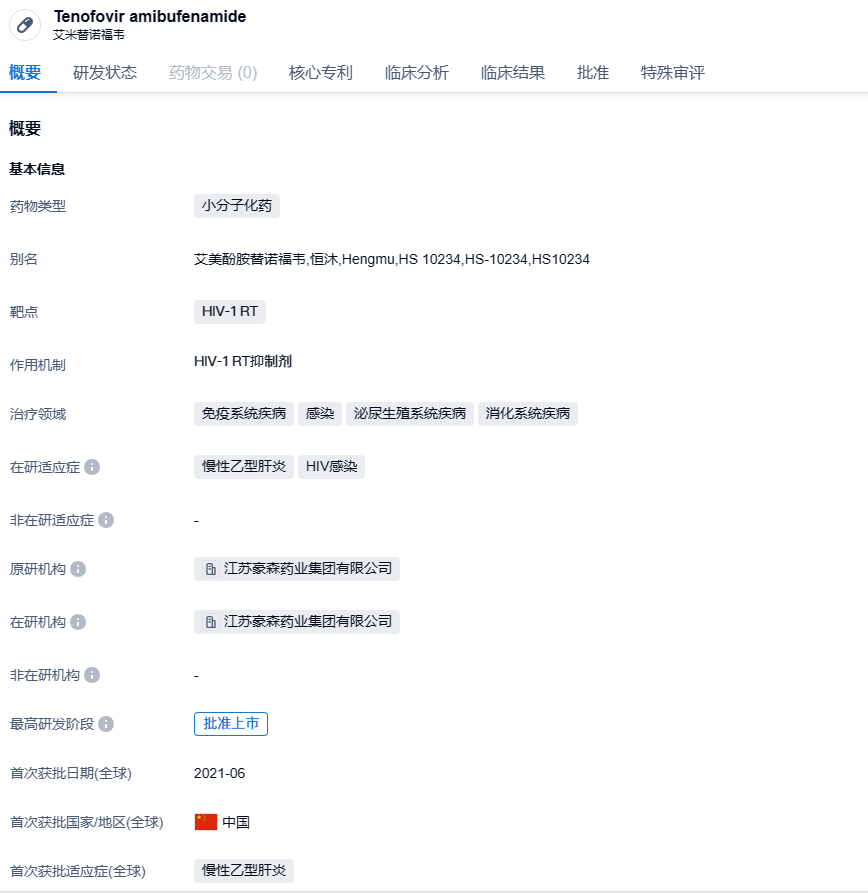
艾米替诺福韦片是翰森制药自主研发的首个中国原研口服抗乙肝病毒创新药,属于HIV-1 RT抑制剂。该药于2021年6月获批上市,为临床医生提供了更优的治疗方案。TMF通过创新的ProTide(磷酰胺酯化前药)技术,实现了替诺福韦(TFV)向肝细胞的靶向输送,在提高肝细胞内活性代谢物TFV-DP浓度的同时,大幅降低血浆中TFV的暴露量,从而在高效抑制HBV复制的同时,降低了长期使用的安全性风险。
此次在AASLD年会上发布的是一项随机、双盲、非劣效性临床试验,在中国49家研究中心开展,共入组1005例慢性乙肝患者,以研究艾米替诺福韦(TMF)对比富马酸替诺福韦二吡呋酯(TDF)144周的疗效和安全性。研究结果显示,与TDF相比,无论基线病毒载量高低(≥8 log10 IU/mL和<8 log10 IU/mL),TMF组与TDF组(定义为0~96周接受TDF治疗,96周后转换为TMF)病毒学应答率(HBV DNA<20 IU/mL)和谷丙转氨酶(ALT)复常率均相当;在TMF组与TDF组中,无论是96周前持续维持病毒应答、低病毒血症还是无病毒学应答的患者,在96周到144周服用TMF后,第144周的病毒学应答和ALT复常率均得到改善。在安全性方面,TMF显示出更优越的骨、肾安全性。
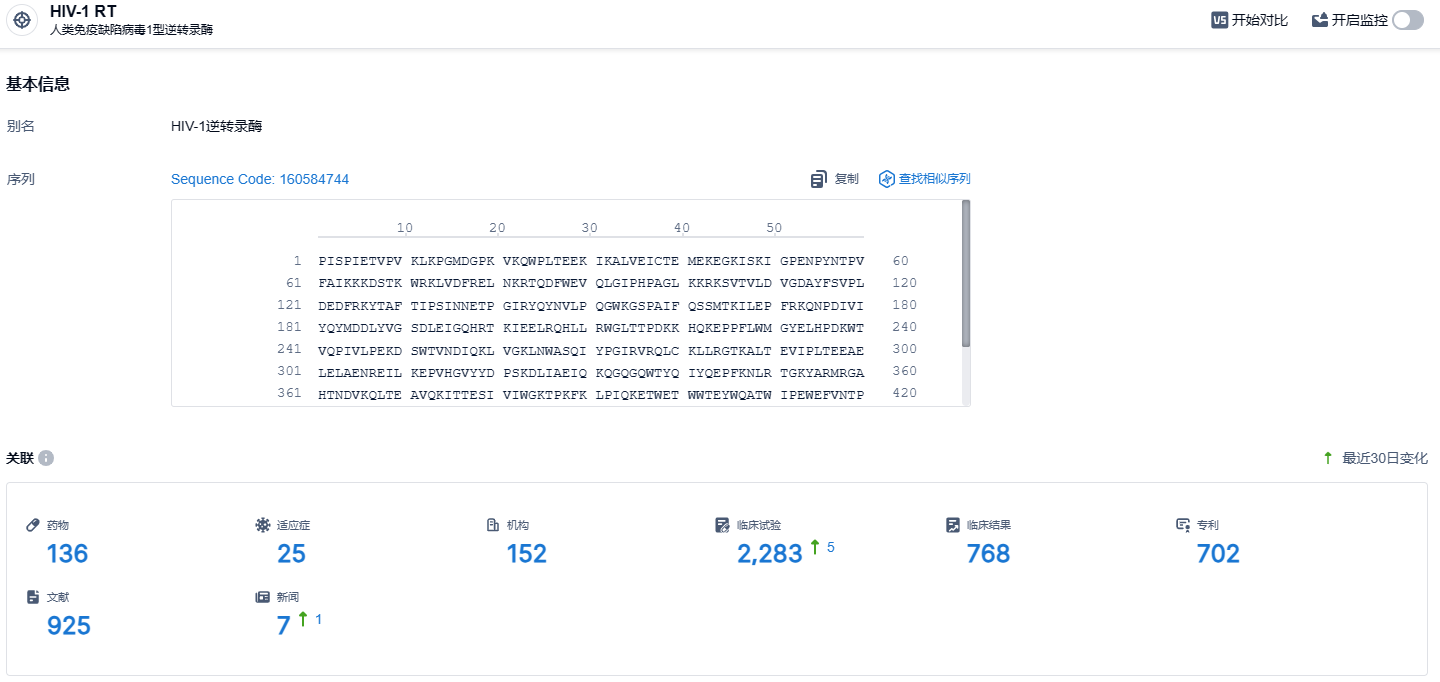
根据智慧芽新药情报库所披露的信息 (点击下方图片直达HIV-1 RT靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月18日,HIV-1 RT靶点共有在研药物136个,包含的适应症有25种,在研机构152家,涉及相关的临床试验2283件,专利多达702件……2023年2月,中华医学会肝病学分会和感染病学分会联合发布《慢性乙型肝炎防治指南(2022年版)》,TMF凭借优异疗效和安全性获得慢乙肝抗病毒治疗首选药物推荐。国内有大约一亿的乙肝患者或携带者,更安全有效的新药研发是广大患者的迫切需求。