康方生物PD-1/CTLA-4双抗卡度尼利单抗注射液新适应症申报上市,针对胃癌
2023年1月5日,CDE官网显示,康方生物卡度尼利单抗(商品名:开坦尼)注射液新适应症上市申请获受理。根据临床试验进展,推测用于一线治疗不可手术切除的局部晚期或转移性胃腺癌或胃食管结合部腺癌(GC/GEJC)。
卡度尼利单抗,是康方生物自主研发的PD-1/CTLA-4双特异性抗体新药,是全球首款获批的基于PD-1的双特异性抗体药物,也是全球首款获批的PD-1/CTLA-4双特异性抗体。该药于2022年6月获国家药监局批准上市,是我国首个获批上市的用于晚期宫颈癌治疗的肿瘤免疫药物,用于治疗既往接受过含铂化疗治疗失败的复发或转移性宫颈癌患者,填补了宫颈癌免疫治疗的市场空白。卡度尼利单抗注射液(开坦尼)在胃癌、肝癌、肺癌、宫颈癌、肾癌、食管鳞癌等多种恶性肿瘤上显示出较好的疗效和安全性。相关临床研究数据显示,卡度尼利单抗与抗PD-1单抗联合抗CTLA-4单抗的联合疗法相比,毒性显著降低,具有明显的安全性和疗效优势。
2023年11月,康方生物宣布,卡度尼利联合奥沙利铂和卡培他滨 (XELOX) 对比安慰剂联合XELOX作为一线治疗不可手术切除的局部晚期或转移性胃腺癌或胃食管结合部腺癌(GC/GEJC)的有效性与安全性的随机、双盲、多中心、III期临床研究(AK104-302)在期中分析中达到主要研究终点。AK104-302研究是全球首个PD-1/CTLA-4双抗联合化疗一线治疗胃癌的III期临床研究,主要研究终点为比较卡度尼利联合XELOX方案与安慰剂联合XELOX方案在意向治疗(ITT)人群的总生存期(OS)。ITT人群中,PD-L1 CPS<5的患者占比约60%,与真实世界中比例相当。结果显示,卡度尼利联合化疗对比安慰剂联合化疗显著延长了全人群(无论PD-L1表达)患者的总生存期(OS),达到预设的优效性标准,安全性特征与既往报道的卡度尼利相关临床研究结果一致,无新的安全性信号。此外,卡度尼利联合化疗显著降低了全人群的死亡风险,包括PD-L1 CPS≥5人群和PD-L1 CPS<5人群,且各人群试验组和对照组间风险比(HR)优于相关PD-1联合化疗联合疗法的已披露数据。卡度尼利联合化疗在PD-L1 CPS<5人群中同样取得了优异的OS数据,显示卡度尼利联合化疗对于PD-1单抗联合化疗响应不佳的PD-L1低表达及阴性人群的治疗同样高效。
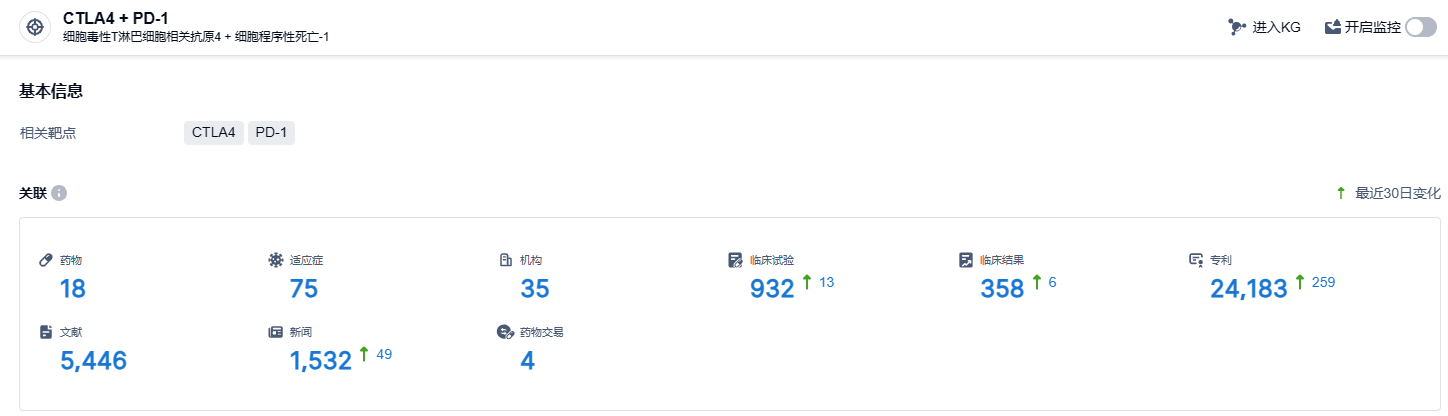
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 CTLA4 + PD-1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年1月6日,CTLA4 + PD-1靶点共有在研药物18个,包含的适应症有75种,在研机构35家,涉及相关的临床试验932件,专利多达24183件……康方生物还在探索卡度尼利单抗在更多适应症上的治疗潜力,包括肺癌、肝癌、胃癌、肾癌、食管鳞癌及鼻咽癌等。其中,卡度尼利单抗用于胃腺癌/胃食管腺癌一线治疗、以及用于早期阶段肝细胞癌新辅助治疗等适应症均已进入注册性临床试验。期待卡度尼利单抗胃腺癌/胃食管腺癌新适应症能够早日获批。