百时美施贵宝CAR-T疗法Breyanzi再获FDA加速批准,针对滤泡性淋巴瘤
2024年5月16日,美国FDA宣布,加速批准百时美施贵宝的CAR-T疗法扩展适应症,用于治疗复发/难治性滤泡性淋巴瘤(FL)成人患者,他们已经接受过两种及以上前期系统治疗。这是Breyanzi在今年3月获得FDA加速批准治疗复发/难治性慢性淋巴细胞白血病(R/R CLL)或小淋巴细胞淋巴瘤(SLL)成人患者后,再度获批扩展适用范围。
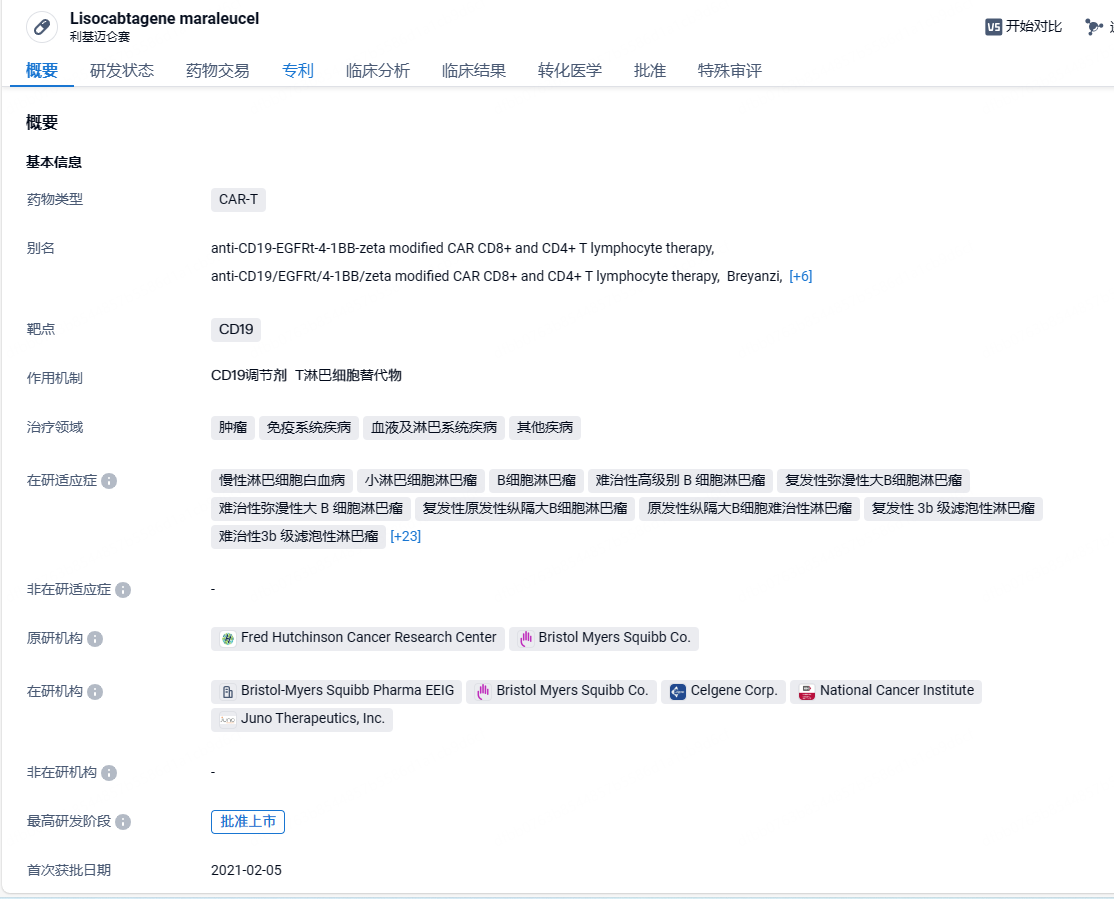
Breyanzi(lisocabtagene maraleucel;liso-cel)是一款靶向CD19的CAR-T细胞疗法,具有4-1BB共刺激结构域,可增强CAR-T细胞的扩增和持久性。这款疗法的独特之处在于CAR-T疗法中CD8阳性和CD4阳性T细胞的比例得到控制,从而可以更好地控制细胞疗法的毒副作用。2021年2月,Breyanzi首次在美国获批上市,用于治疗接受过两种或多种系统治疗的复发或难治性大B细胞淋巴瘤(LBCL)成人患者,包括未另有说明的弥漫性大B细胞淋巴瘤(DLBCL)、高级别B细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤和3B级FL。今年1月底,Breyanzi用于治疗接受过BTK抑制剂治疗的复发或难治性滤泡性淋巴瘤(FL)和套细胞淋巴瘤(MCL)成年患者的两项补充生物制品许可申请(sBLA)已获FDA受理和优先审评,PDUFA日期分别为2024年5月23日和2024年5月31日。
这一加速批准是基于2期临床试验TRANSCEND-FL的积极结果。在这项单臂,开放标签临床试验中,接受Breyanzi治疗的患者在中位随访时间为16.8个月时,总缓解率(ORR)达到95.7%(95% CI:89.5%,98.8%),中位缓解持续时间尚未达到(95% CI:18.04,NR)。关于安全性,至少20%的患者报告的最常见的非实验室不良反应包括细胞因子释放综合征、头痛、肌肉骨骼疼痛、疲劳、便秘和发烧。
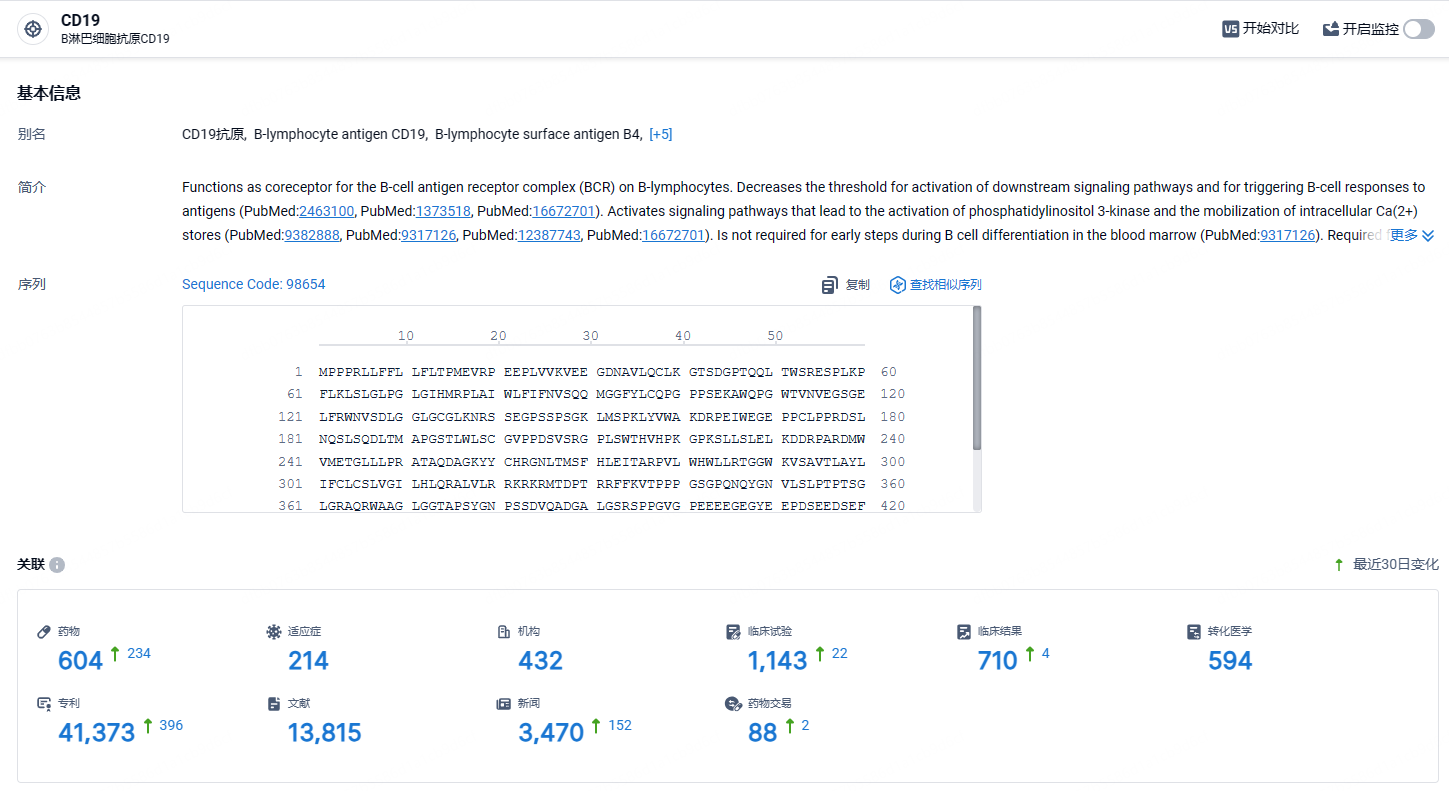
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达CD19靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年5月16日,CD19靶点共有在研药物604个,包含的适应症有214种,在研机构432家,涉及相关的临床试验1143件,专利多达41373件……Breyanzi在2023年销售收入3.64亿美元,未来商业化可期。期待该药早日在国内获批,为国内患者带来新的治疗选择。