GSK旗下BCMA ADC belantamab mafodotin III期临床达到终点,头对头达雷妥尤单抗
11月14日,葛兰素史克(GSK)宣布一项评估BCMA ADC药物Blenrep(belantamab mafodotin)联合硼替佐米和地塞米松(BorDex)头对头对比达雷妥尤单抗联合BorDex二线治疗复发或难治性多发性骨髓瘤(RRMM)的III期DREAMM-7研究的中期分析取得积极结果,到达了总生存期(OS)的关键次要终点。详细数据将在12月举行的第66届美国血液学会 (ASH) 年会上公布。
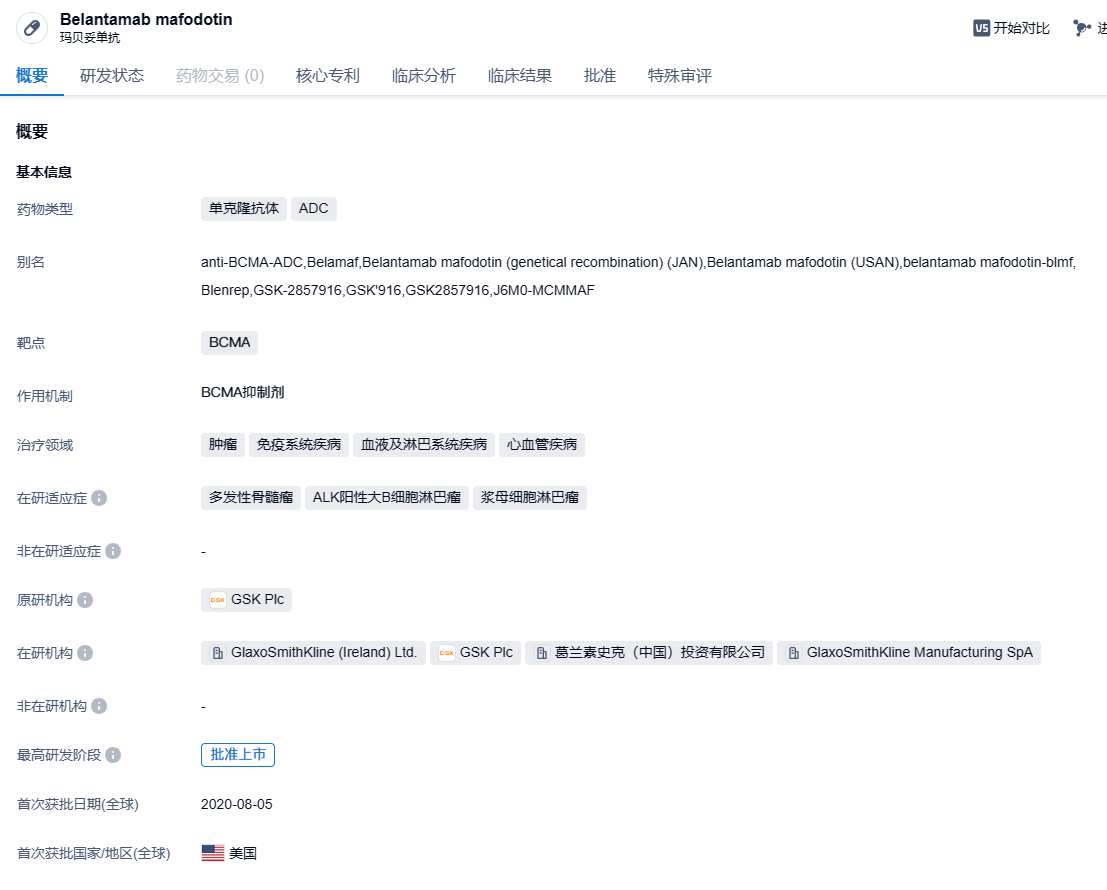
Blenrep(Belantamab mafodotin)是GSK开发的一种抗体偶联药物,由靶向B细胞成熟抗原(BCMA)的单克隆抗体与毒性载荷auristatin F通过不可切断的连接子连接而成。2020 年 8 月获 FDA 加速批准用于治疗先前经过四线治疗失败的多发性骨髓瘤(MM)患者。2022年 11 月,GSK 宣布基于确证性 III 期临床 DREAMM-3 研究的失败,已应美国 FDA 的要求,启动了撤销 Blenrep 美国上市许可的程序。为探索Blenrep作为多发性骨髓瘤患者的二线治疗方案的应用潜力,GSK此前还开展了两项III期研究(DREAMM-7和DREAMM-8)。这两项研究已分别于2023年11月和今年6月达到主要终点。基于后续研究的成功,这款BCMA ADC又在全球医药市场重新发起了商业化冲锋。
DREAMM-7 研究是一项多中心、开放标签随机试验,共纳入494例患者,按1:1比例随机分组接受belantamab mafodotin与BorDex联合治疗,或接受达雷妥尤单抗与BorDex联合治疗。此前已公布的临床试验数据显示,belantamab mafodotin治疗组患者(n=243)的PFS为36.6个月(95% CI:28.4-NR),较对照组患者(n=251)的13.4个月(95% CI:11.1-17.5)延长了近2年,并且疾病进展或死亡风险降低了近60%(HR:0.41,95% CI:0.31-0.53,p<0.00001),达到了主要终点。
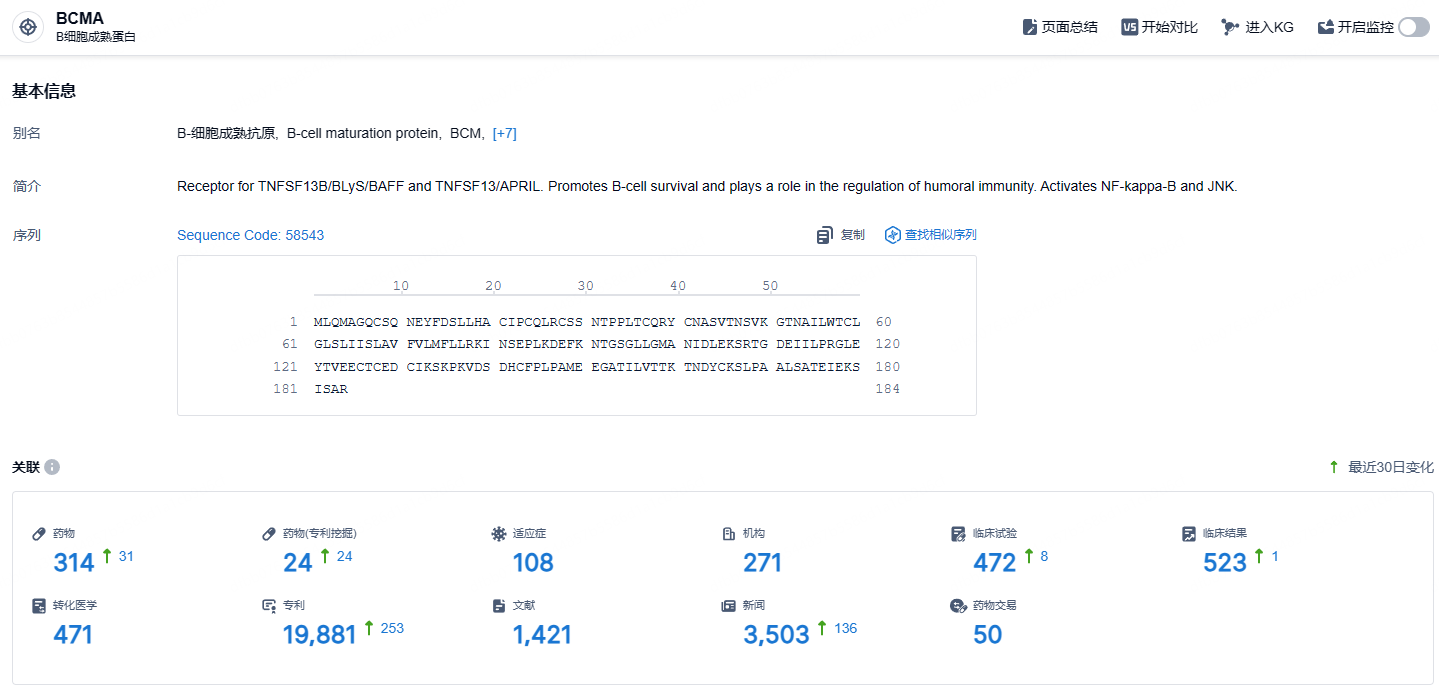
根据智慧芽新药情报库所披露的信息 (点击下方图片直达BCMA靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年11月17日,BCMA靶点共有在研药物314个,包含的适应症有108种,在研机构271家,涉及相关的临床试验472件,专利多达19881件……当前全球在研的 BCMA ADC 不足20款,上市的BCMA产品以CAR-T产品为主。期待belantamab mafodotin能够再次上市,并且商业化成功。




![诺华靶向PSMA核药镥[177Lu] 特昔维匹肽注射液在中国申报上市](https://synapse-static.zhihuiya.com/strapi-static/blog_71_0dba15b2c3.jpg)