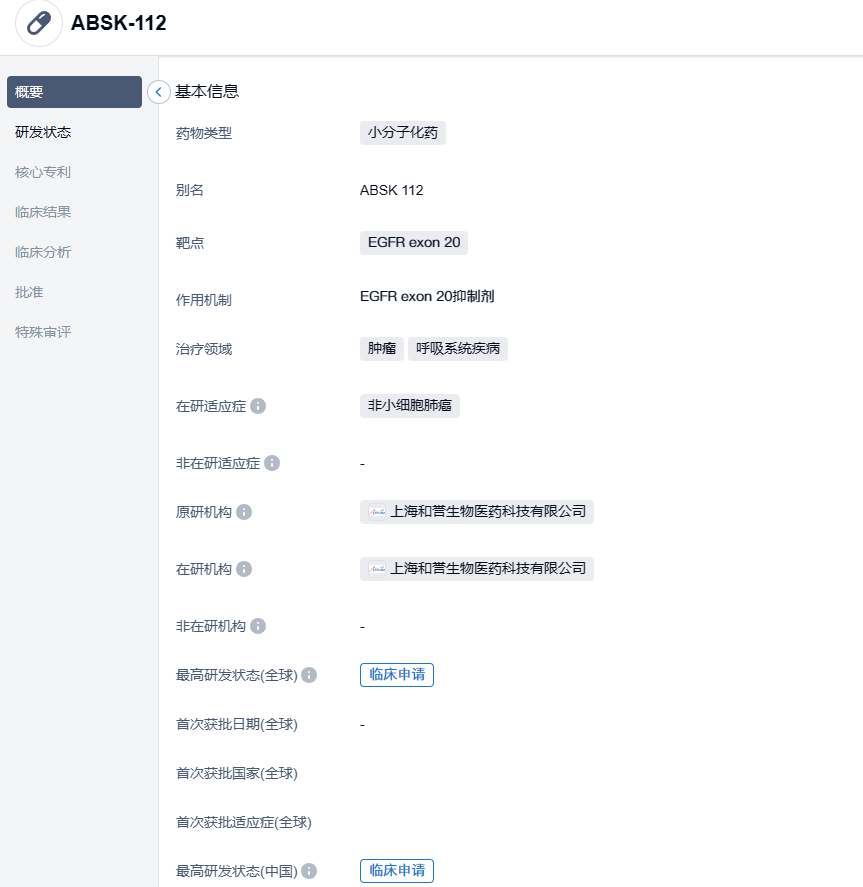
和誉医药EGFR exon20ins抑制剂ABSK112在中国获批临床,治疗非小细胞肺癌
2023年10月27日,和誉医药宣布,其自主研发的新一代EGFR Exon20ins抑制剂ABSK112临床试验申请获得中国国家药品监督管理局(NMPA)批准,即将开展针对非小细胞肺癌(NSCLC)的中国首次人体1期临床试验。ABSK112此前已经获得美国FDA的临床研究许可,1期研究将在中美两地同步开展。
ABSK112是一款具有优异活性、选择性、和入脑特性的二代EGFR Exon20ins口服抑制剂。相较于此前已上市或已进入临床试验的EGFR Exon20ins抑制剂,ABSK112在临床前研究中展现出更优的入脑特性、针对野生型EGFR的更优选择性、以及更广泛的Exon20ins突变覆盖谱,并在多种 EGFR Exon20ins突变的小鼠肿瘤模型中表现出积极的体内药效,具备了在临床上获得更好安全窗和药效并成为新一代同类优效药物的潜力。
根据和誉医药新闻稿,此次ABSK112获批开展的是一项首次人体(FIH)、多中心、非随机、开放性1期试验。此项研究首先在NSCLC患者中进行ABSK112的剂量递增,旨在评价研究药物的安全性、耐受性、药代动力学(PK)和初步抗肿瘤活性。
肺癌是世界上第二常见的癌症,2020年其新发病例超过200万,其中美国22万7875例,中国81万5563例。肺癌死亡率高居首位,每年死亡人数超过170万,其中美国13万8225例(7.7%),中国71万4699例(39.8%)。非小细胞肺癌(NSCLC)在所有肺癌中占比最高(85%)。在白种人和亚洲人中,分别约17%和50%的肺腺癌中出现了表皮生长因子受体(EGFR)突变。ABSK112瞄准NSCLC这一有着庞大患病群体的适应症,一旦成功获批,市场潜力巨大。
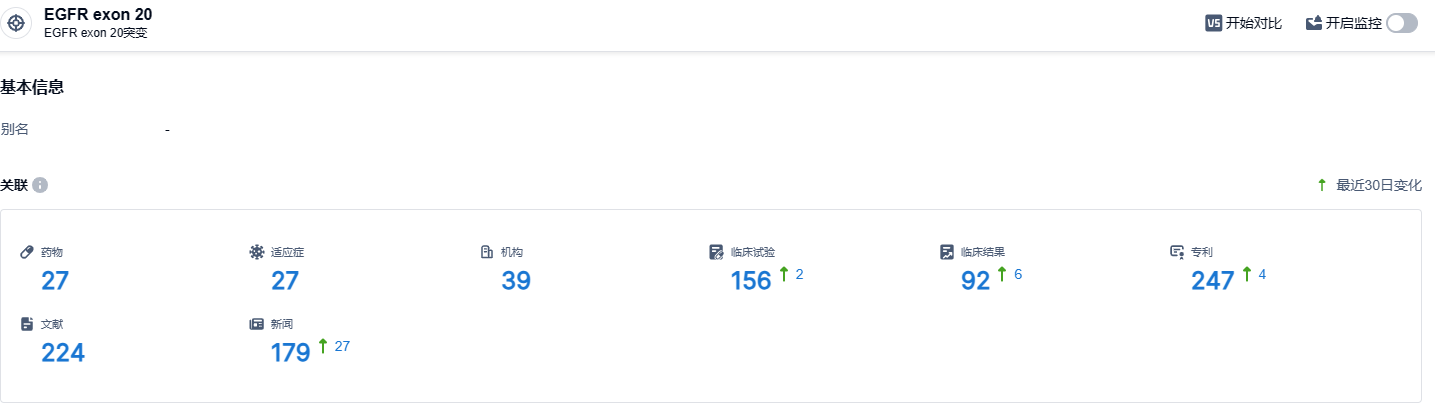
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达EGFR exon 20 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年10月28日,EGFR exon 20靶点共有在研药物27个,包含的适应症有27种,在研机构39家,涉及相关的临床试验156件,专利多达247件……期待ABSK112后续研发顺利,给患者带来新的治疗选择。