和黄医药Syk抑制剂醋酸索乐匹尼布拟纳入优先审评,治疗血小板减少症
2023年12月7日,中国国家药监局药品审评中心(CDE)官网公示,和黄医药申报的Syk抑制剂醋酸索乐匹尼布片拟纳入优先审评,拟定适应症为:既往接受过一线标准治疗(糖皮质激素、免疫球蛋白)无效或复发的成人原发慢性免疫性血小板减少症(ITP)。
索乐匹尼布(HMPL-523)是和黄医药开发的一种选择性的小分子口服脾酪氨酸激酶(Syk)抑制剂。Syk是B细胞受体和Fc受体信号传导通路下游关键的激酶,能够用于多种B细胞淋巴瘤及自身免疫疾病的治疗。索乐匹尼布可以抑制酪氨酸激酶依赖性Fcγ受体介导的巨噬细胞吞噬作用进而减少血小板的吞噬破坏,同时也可以减少B细胞产生抗血小板抗体,二者共同协调,最终达到血小板破坏减低的效果,从而提升血小板数量。索乐匹尼布于2022年1月获中国国家药监局(NMPA)纳入突破性治疗品种,用于ESLIM-01研究所探索的适应症。除了免疫性血小板减少症外,索乐匹尼布用于治疗温抗体性自身免疫性溶血性贫血和惰性非霍奇金淋巴瘤的研究也在进行中。2023年8月21日,和黄医药宣布,Syk抑制剂索乐匹尼布探索用于治疗成人原发免疫性血小板减少症(ITP)的中国关键性3期研究ESLIM-01已达到持续应答率这一主要终点以及所有的次要终点。

此前达到主要终点的ESLIM-01研究是一项在中国开展的随机、双盲、安慰剂对照的3期临床试验,共纳入188名既往接受过至少一种治疗的慢性成人原发免疫性血小板减少症患者。研究于2022年12月完成患者入组。该试验成功达到了其主要终点,即与接受安慰剂治疗的患者相比,接受索乐匹尼布治疗的患者持续应答率取得了具有临床意义和统计学意义的显著改善,包括总体应答率和安全性在内的所有次要终点也已达到。该试验完整的研究数据将提交于近期的学术会议上发表。
此前,索乐匹尼布治疗ITP的Ib/II期临床研究发表于《The Lancet Haematology》。这项随机、双盲、安慰剂对照的Ib/II期研究(NCT03951623)旨在评估索乐匹尼布用于ITP患者的安全性和药代动力学,确定Ib/II期研究剂量(RP2D)并评估初步疗效。研究在2019 年 5 月 30 日至 2021 年 4 月 22 日期间,将45 名中国患者随机分组(34 名 HMPL-523 vs 11 名安慰剂),在 0-8 周内,索乐匹尼布的总体应答率高于安慰剂(69% [11/16] vs 9% [1/11])。在300mg qd剂量组中,索乐匹尼布(Sovleplenib)的疗效尤为突出,其总体应答率为80%,持续应答率为40%,75%的患者在治疗第8天血小板计数即达到>30×109/L。同时,研究中未出现患者血小板计数高于正常上限(300×109/L)以及血栓事件等情况,患者治疗中血栓的发生风险较低。
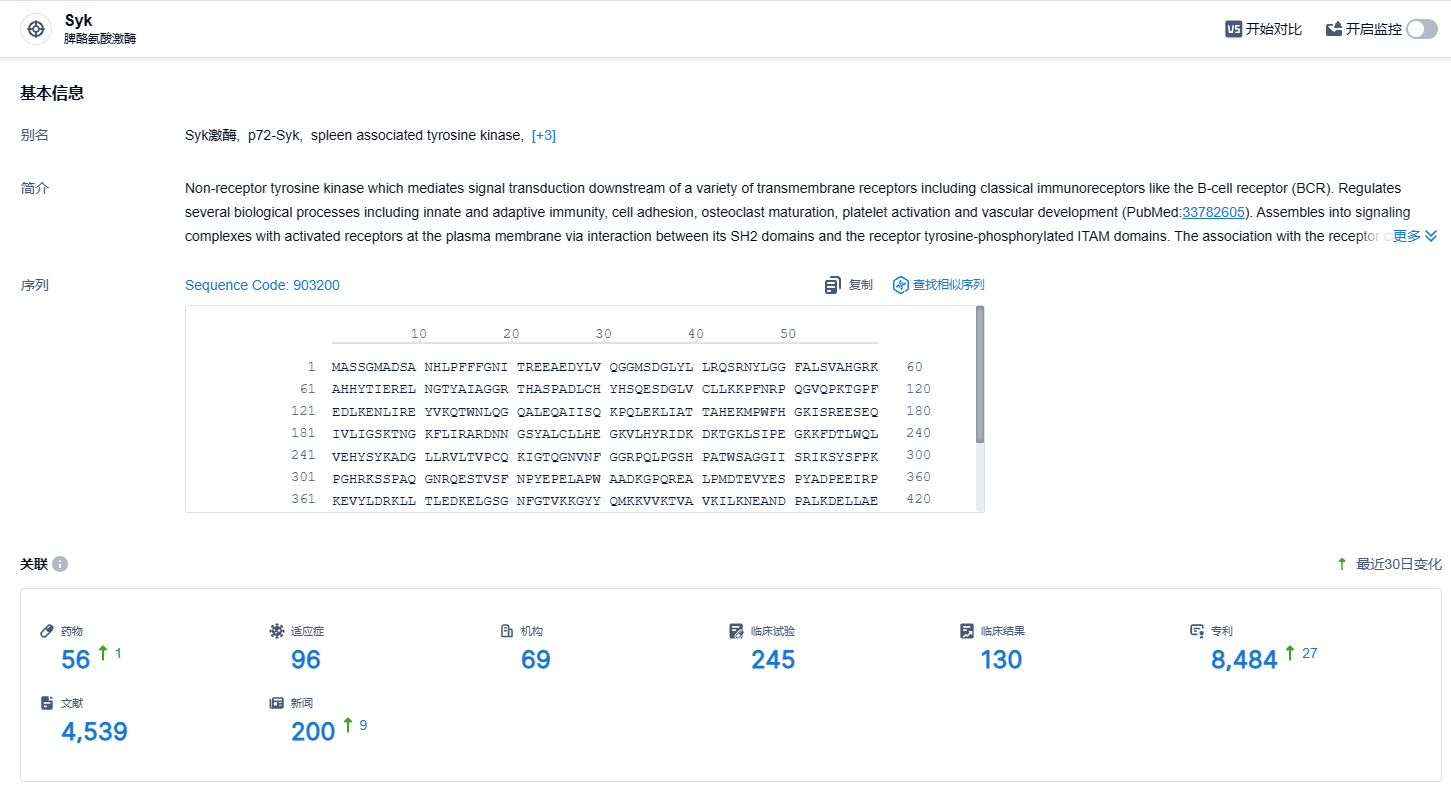
根据智慧芽新药情报库所披露的信息 (点击下方图片直达Syk靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年12月8日,Syk靶点共有在研药物56个,包含的适应症有96种,在研机构69家,涉及相关的临床试验245件,专利多达8484件……慢性成人原发免疫性血小板减少症是一种长期存在的异质性疾病,仍然非常需要新的治疗方法,索乐匹尼布为这些既往接受过至少一种治疗的患者提供了一种潜在新选择。