信达生物公布抗PD-1单抗最新3期临床结果在JAMA主刊发表,治疗胃癌
2023年12月6日,信达生物宣布在《美国医学会杂志》(JAMA)主刊发表信迪利单抗注射液联合化疗一线治疗胃及胃食管交界处腺癌的3期临床研究ORIENT-16的期中分析结果。
信迪利单抗,中国商品名为达伯舒®(信迪利单抗注射液),是信达生物制药和礼来制药共同合作研发的创新PD-1抑制剂药物。信迪利单抗是一种人类免疫球蛋白G4(IgG4)单克隆抗体,能特异性结合T细胞表面的PD-1分子,从而阻断导致肿瘤免疫耐受的PD-1/程序性死亡受体配体1(ProgrammedDeath-Ligand1,PD-L1)通路,重新激活淋巴细胞的抗肿瘤活性,从而达到治疗肿瘤的目的。目前有超过二十多个临床研究(其中10多项是注册临床试验)正在进行,以评估信迪利单抗在各类实体肿瘤和血液肿瘤上的抗肿瘤作用。
ORIENT-16研究是一项比较信迪利单抗或安慰剂联合化疗(奥沙利铂+卡培他滨)一线治疗不可切除的局部晚期、复发性或转移性胃及胃食管交界处腺癌的有效性和安全性的随机、双盲、多中心、3期研究。主要研究终点为总体人群和PD-L1阳性人群(CPS≥5)的总生存期(OS)。该研究在预设的期中分析时即达到了该研究的主要终点,在全人群和PD-L1阳性(CPS≥5)中均显示出总生存期的显著获益。本次JAMA全文发表了ORIENT-16期中分析的结果。
期中分析结果显示(截至2021年6月20日,中位随访时间18.8个月),信迪利单抗联合化疗显著降低总体人群(HR0.77,95%CI0.63-0.94,p=0.009)和CPS≥5人群(HR0.66,95%CI0.50-0.86,p=0.002)的死亡风险,达到预设的优效性标准;中位生存期(mOS)在总体人群延长2.9个月(mOS15.2月vs.12.3月),在CPS≥5人群延长5.5个月(mOS18.4月vs.12.9月)。总生存期在预设的所有亚组分析中获益趋势一致。安全性特征与既往报道的信迪利单抗相关临床研究结果一致,无新的安全性信号。
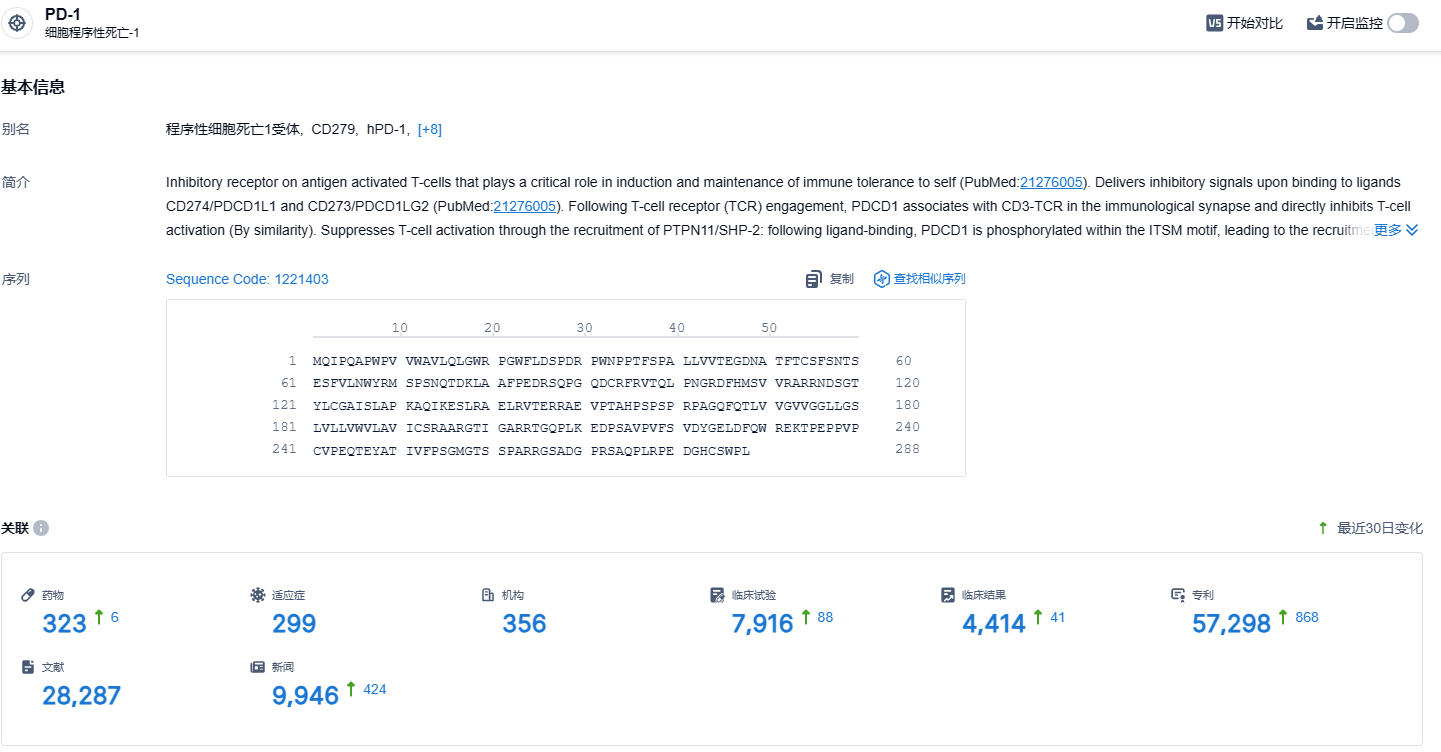
根据智慧芽新药情报库所披露的信息(点击下方卡片直达PD-1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2023年12月7日,PD-1靶点共有在研药物323个,包含的适应症有299种,在研机构356家,涉及相关的临床试验7916件,专利多达57298件……PD-1靶点是研发非常火热的领域,国内外均有众多企业布局,信迪利单抗作为该领域的明星产品,期待该药的后续表现。