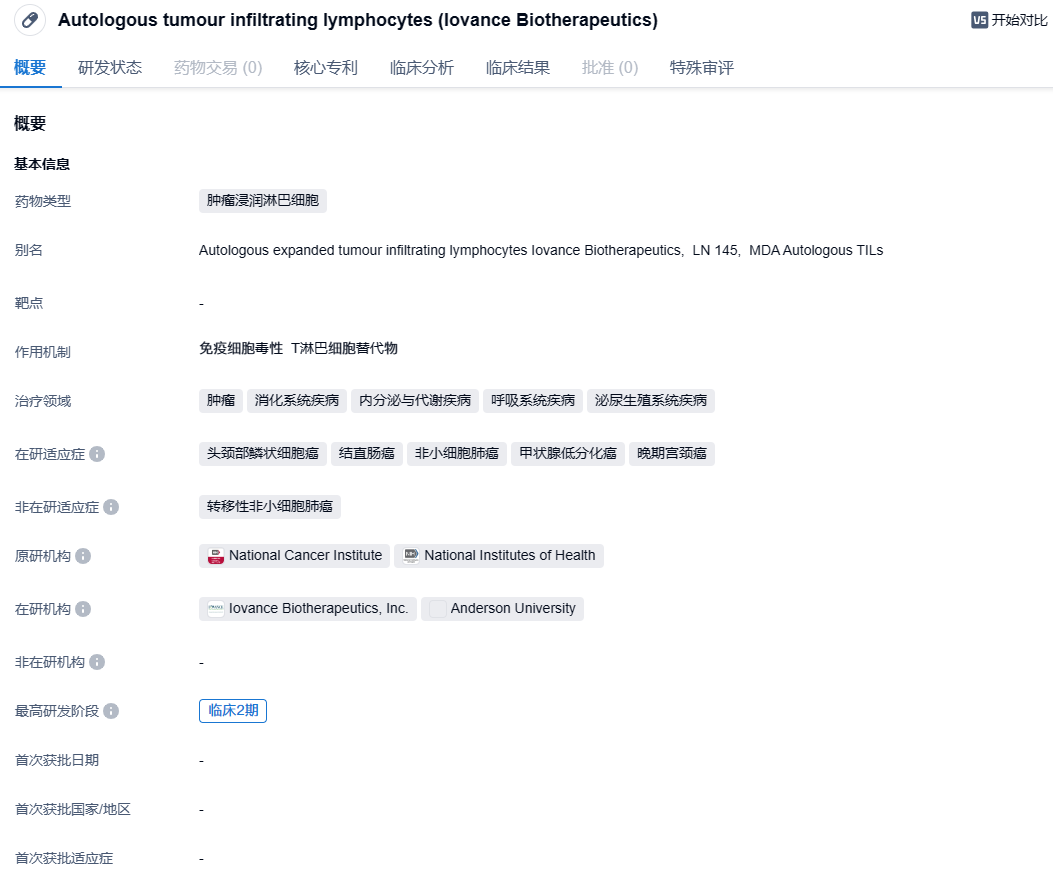
Iovance公司TIL疗法LN-145临床试验遭FDA暂停,针对非小细胞肺癌
2023年12月27日,Iovance Biotherapeutics宣布FDA于近日(12月22日)暂停了TIL疗法LN-145一项代号为IOV-LUN-202的临床试验,以回应最近报道的可能与非清髓性淋巴细胞清除预处理方案相关的5级(致命:一名患者死亡)严重不良事件。
LN-145是由Iovance公司开发的基于患者自身的肿瘤浸润淋巴细胞(TIL therapy)构建的细胞疗法,这些TIL在癌症发生时会迁移到肿瘤处并且对肿瘤发起攻击。然而,通常患者体内的TIL数目不足以消灭肿瘤,而且肿瘤微环境会抑制TIL的功能。这款疗法通过从患者体内获取肿瘤组织并且提取TIL,然后在体外使用IL-2细胞因子以刺激TIL的扩增。这一体外刺激手段不但增加了TIL的数量,还能激活TIL的抗肿瘤能力。然后这些TIL被注回患者体内,更有效地杀伤肿瘤细胞。
IOV-LUN-202是一项单臂、II期试验,主要评估了LN-145在晚期非小细胞肺癌患者中的疗效和安全性。该项试验的最新数据包括了23例接受LN-145治疗的非小细胞肺癌患者。试验结果显示,客观缓解率(ORR)为26.1%,其中包含1例完全缓解和5例部分缓解患者。此外,疾病控制率(DCR)达82.6%。试验的中位缓解持续时间(DOR)尚未达成,DOR的范围是1.4+个月至9.7+个月。在安全性方面,治疗中出现的不良事件与基础疾病以及非清髓性淋巴细胞减少和白细胞介素-2的已知不良事件相一致。
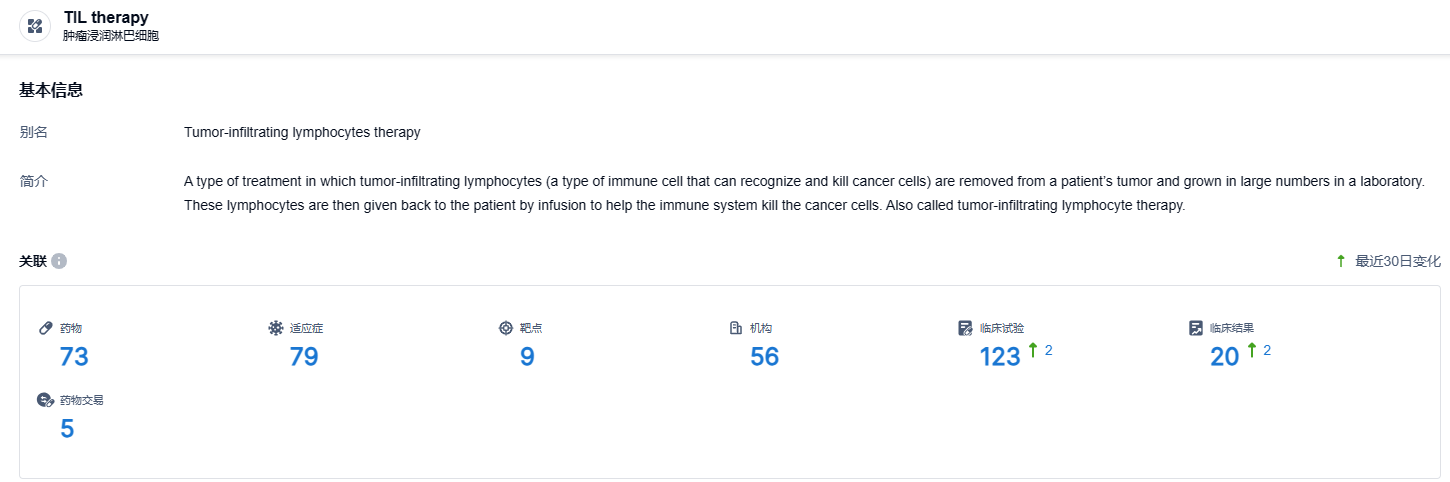
根据智慧芽新药情报库所披露的信息 (点击下方图片直达TIL therapy 药物类型 注册登录后可免费获得该靶点下的在研药物、适应症、靶点、临床试验等详细信息),截止到 2023 年12月29日,TIL therapy共有在研药物73个,包含的适应症有79种,靶点有9个,机构有56个,涉及相关的临床试验123件……Jefferies 分析师表示,围绕预处理方案的安全问题可能是由感染引起的,预计重新启动LN-145研究需要 90 至 120 天的时间。期待LN-145后续研发顺利。