Ipsen/GENFIT新药elafibranor全球上市申请提交在即,肝病3期试验达主要终点!
近日,Ipsen和GENFIT共同宣布其关键性3期ELATIVE试验的全部结果,该试验同时公布于美国肝病研究协会(AASLD)年会并发表在《新英格兰医学杂志》上。该试验评估其在研小分子elafibranor用于治疗原发性胆汁性肝硬化(PBC)患者的疗效和安全性。该试验的积极结果将支持elafibranor作为PBC潜在疗法的全球上市监管申请。
Elafibranor是一款同时激活PPARα + PPARδ的双重激动剂。这两种核受体介导多种生理过程,包括脂肪代谢,葡萄糖代谢平衡,炎症等等。Elafibranor与其它PPAR受体激动剂的区别在于它不会激活PPARγ受体。因此,它不会引起与PPARγ受体激活相关的毒副作用,例如体重上升、浮肿、和液体潴留,这可能增加患者的心血管疾病风险。它已经获得美国FDA授予的突破性疗法认定,用于治疗PBC。
分析显示,患者在各关键终点的疾病进展生物标志物上均出现具有统计学意义的改善,主要复合终点达到显著治疗获益,显示80 mg elafibranor组(51%)达到生化应答的患者与安慰剂组(4%)相比的差异为47%(P<0.001)。ALP和胆红素是PBC疾病进展的重要预测因素。两者水平降低可能显示胆汁淤积性损伤减轻,肝功能改善。此外,只有接受elafibranor治疗的患者在第52周达到ALP正常值,包含15%药物组患者与0%安慰剂组患者(P=0.002),这是试验的一个关键次要终点。Elafibranor显著的生化效应亦显示于患者ALP水平较基线快速降低。Elafibranor组患者早在第4周就可观察到ALP水平下降,并持续至第52周,与安慰剂组相比,elafibranor组的ALP降低幅度达41%。Elafibranor的耐受性良好,所显示的安全性特征与既往试验一致。
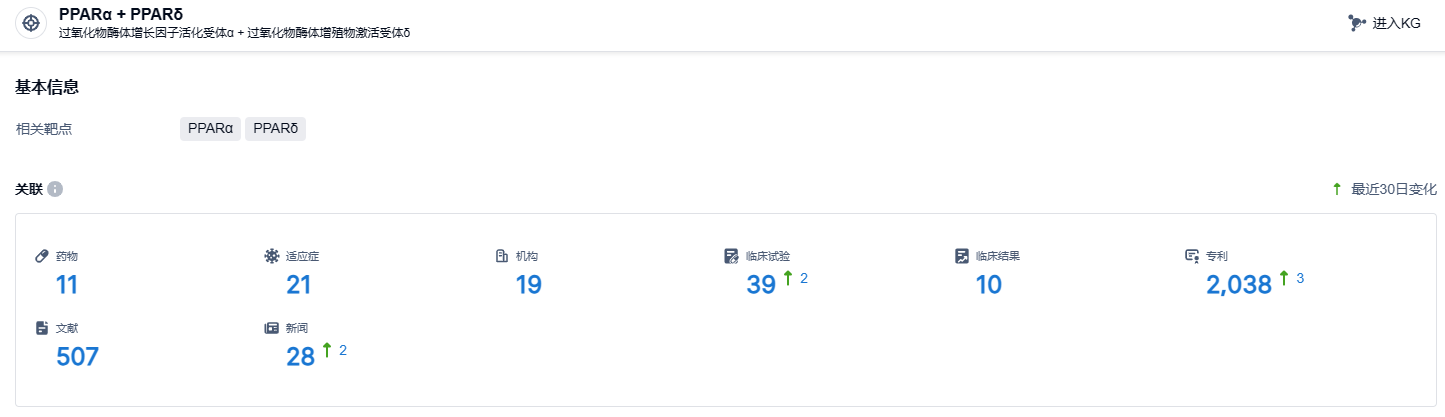
根据智慧芽新药情报库所披露的信息 (点击下方图片直达PPARα + PPARδ靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月16日,PPARα + PPARδ靶点共有在研药物11个,包含的适应症有21种,在研机构19家,涉及相关的临床试验39件,专利多达2038件……原发性胆汁性肝硬化每年的发病率在2.27~32/100万,男∶女=1∶10,近年发病率增加。原发性胆汁性肝硬化是以小叶间胆管破坏导致逐渐进展的胆管阻塞及胆汁淤积,引起肝纤维化、肝硬化并最终导致肝衰竭的进行性破坏性疾病。期待elafibranor能够早日上市,为患者带来新的治疗选择。