强生GPRC5D/CD3双抗talquetamab获FDA批准上市,治疗多发性骨髓瘤
2023年8月10日,强生宣布,美国FDA加速批准该公司GPRC5D/CD3双抗TALVEY™(talquetamab)上市,用于治疗复发或难治性多发性骨髓瘤(RRMM)成人患者,这些患者先前至少接受过4种治疗,包括蛋白酶体抑制剂,免疫调节剂和CD38抗体。
talquetamab(JNJ-64407564)是由强生开发的一款靶向GPRC5D/CD3的双特异抗体,该抗体的构建采用Genmab的DuoBody双特异抗体平台,抗体亚型为IgG4并进行了S228P,F234A, L235A突变。GPRC5D名为G蛋白偶联孤儿受体,是一种新的药物靶点,其在恶性浆细胞上过表达,在正常组织的表达仅限于皮肤(毛囊和小汗腺)和睾丸(输精小管),且其表达水平与靶点BCMA相对独立。talquetamab通过激活CD3阳性T细胞,诱导T细胞对GPRC5D阳性MM细胞进行杀伤。talquetamab于2022年6月获得美国FDA授予的治疗RRMM成人患者突破性疗法资格。2021年5月和2021年8月,talquetamab分别被美国FDA和欧盟委员会指定为治疗多发性骨髓瘤的孤儿药。2021年1月,talquetamab获得了欧盟委员会的优先药物(PRIME)称号。
此次批准是基于II期MonumenTAL-1研究结果,旨在评估皮下注射talquetamab治疗R/R MM患者的疗效,其中包括既往接受过至少4种治疗且未接受过T细胞疗法的患者(n=187),该研究显示出有意义的总缓解率(ORR)。当给药频率为每两周皮下注射0.8 mg/kg时,73.6%的患者(95%置信区间[CI],范围为63.0-82.4)达到ORR。从受试者首次出现缓解开始,中位随访时间接近6个月(范围0 - 9.5个月),58%的患者获得了非常好的部分缓解(VGPR)或更好,其中33%的患者获得了完全缓解(CR)或更好。当给药频率为每周皮下注射剂0.4 mg/kg时,73.0%的患者(95% CI,范围63.2-81.4)达到ORR。从受试者首次出现缓解开始的中位随访时间接近14个月(范围0.8至15.4个月),57%的患者达到VGPR或更好,其中35%的患者达到CR或更好。
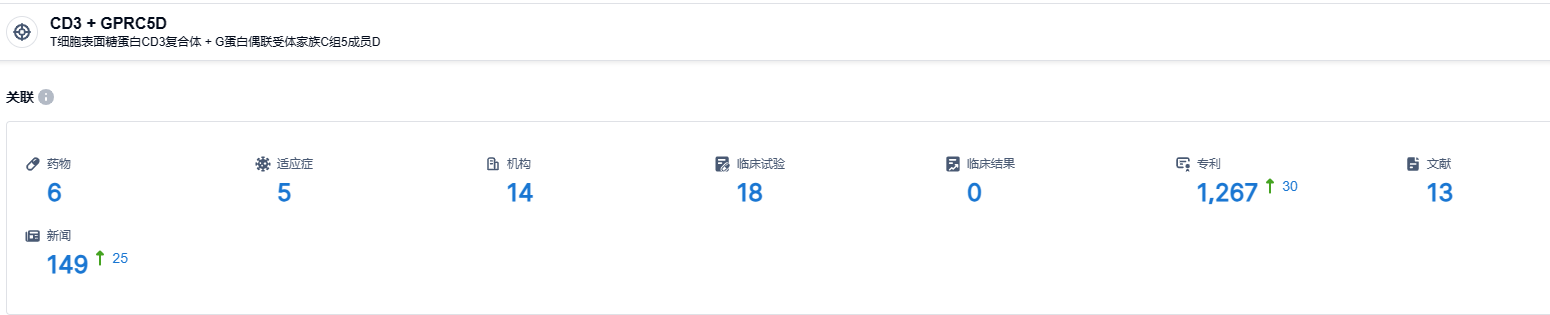
根据智慧芽新药情报库所披露的信息 (点击下方图片直达GPRC5D/CD3 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年8月12日,GPRC5D/CD3 靶点共有在研药物6个,包含的适应症有5种,在研机构14家,涉及相关的临床试验18件,专利多达1267件……多发性骨髓瘤是强生重点布局领域,通过单/双抗、细胞疗法、诱导性多能干细胞等技术平台的开发,强生有望建立多发性骨髓瘤新的治疗模式。