“广谱”抗癌新药,杨森FGFR抑制剂erdafitinib II期临床试验研究结果积极
近日,杨森(Janssen)公司的FGFR抑制剂erdafitinib的一项国际、单臂、2期研究(RAGNAR研究)结果在《柳叶刀》子刊The Lancet Oncology上发表。该研究数据显示,在患者用尽其它治疗方案的情况下,erdafitinib能够为FGFR基因变异的晚期实体瘤(不限瘤种)患者带来临床获益。与基线时相比,73%的患者肿瘤负荷减少,患者的ORR为30%,研究达到了主要终点。
Balversa (erdafitinib,厄达替尼) 是杨森开发的一款 FGFR 酪氨酸激酶抑制剂,具有抗肿瘤活性,该药是首款被FDA批准的口服FGFR抑制剂。2019年4月,FDA加速批准厄达替尼用于治疗携带有FGFR3或FGFR2突变的铂类化疗后疾病进展的局部晚期或转移性膀胱癌成人患者,包括新辅助或辅助铂化疗12个月内的患者。FGFRs是一类典型的受体酪氨酸激酶(receptor tyrosine kinases,RTKs),其家族包括FGFR1、FGFR2、FGFR3和FGFR4四种受体。研究表明FGFR的高表达、突变等导致其信号通路异常激活,异常激活使肿瘤细胞以"自给自足"的方式维持生长,促进细胞增殖、上皮间质转化和血管生成以及肿瘤细胞的侵袭、转移和对治疗的耐受,与乳腺癌、肺癌、尿路上皮癌、子宫内膜癌、卵巢癌等多种疾病的发生发展密切相关。
本次在《柳叶刀》子刊上发表的是一项名为RAGNAR的单臂、2期研究旨在评估erdafitinib治疗FGFR变异阳性晚期实体瘤的抗肿瘤活性和安全性。研究在15个国家的156家医学中心开展,共包含4个队列。患者纳入标准包括:年龄≥12岁;伴有FGFR1~4遗传变异的任何组织学类型晚期或转移性肿瘤(尿路上皮癌除外);至少接受过一种全身性治疗方案后发生疾病进展;无替代标准治疗方案;ECOG体能状态评分为0-1分。入组患者接受erdafitinib每日一次口服治疗(连续21天为一个周期),直至疾病进展或出现不可耐受的毒性。研究主要终点为独立审评委员会评估的客观缓解率(ORR)。分析结果显示,与基线时相比,73%(159/217)的患者肿瘤负荷减少,患者的ORR为30%(64/217),研究达到主要终点。在发生客观缓解的患者中,其中有3%为完全缓解;27%为部分缓解。
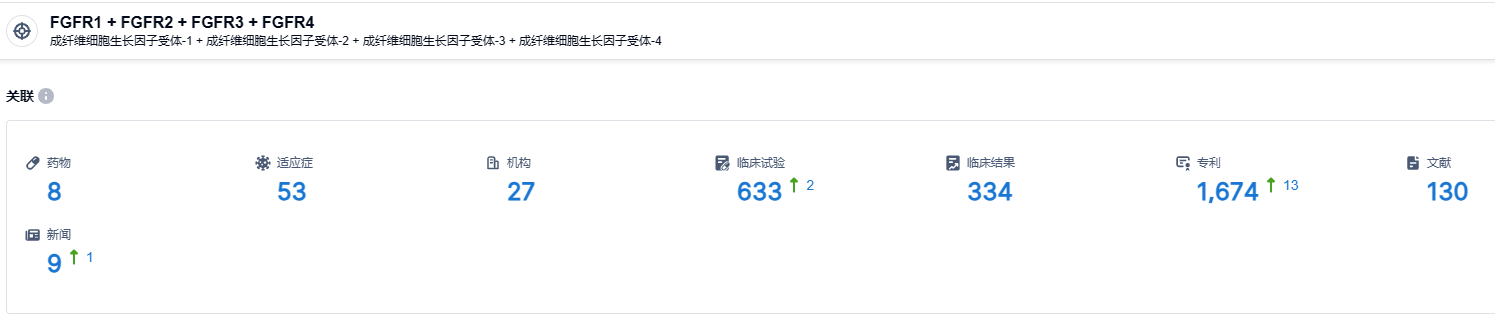
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 FGFR1 + FGFR2 + FGFR3 + FGFR4 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年8月11日,FGFR1 + FGFR2 + FGFR3 + FGFR4靶点共有在研药物8个,包含的适应症有53种,在研机构27家,涉及相关的临床试验633件,临床试验结果334件,专利多达1674件……erdafitinib在具有FGFR基因突变的晚期实体瘤患者中具有良好的疗效,能使大批患者受益,能够为已经没有治疗选择的患者群体提供一种有效的治疗手段。这些结果将支持Erdafitinib在晚期实体瘤患者中的继续研究和开发。