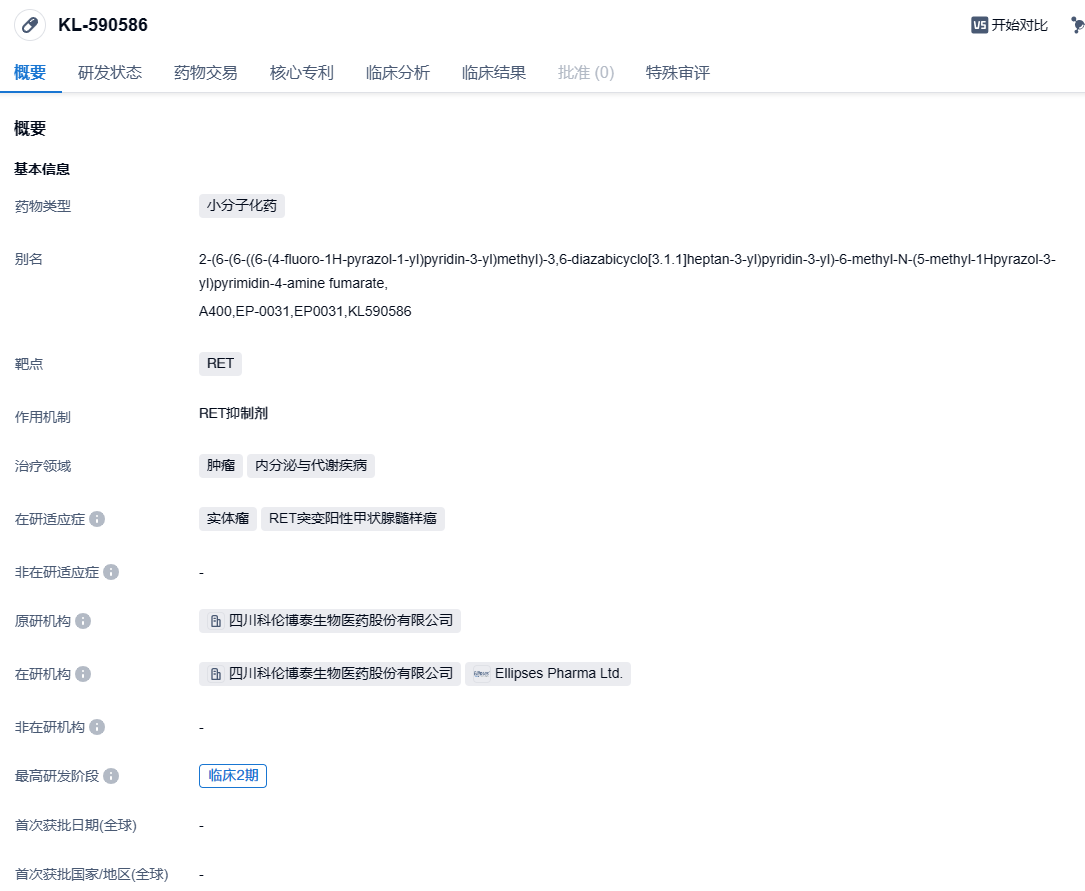
科伦博泰宣布新一代RET抑制剂KL590586获FDA孤儿药资格
2023年11月27日,科伦博泰发布新闻稿称,其海外合作伙伴Ellipses Pharma引进的RET小分子激酶抑制剂KL590586(EP0031,简称A400),获得了美国FDA授予的孤儿药资格,用于治疗RET融合阳性实体瘤。
KL590586是新一代选择性RET抑制剂(SRI),对常见的RET基因融合和突变具有广泛活性,且具有克服第一代SRI耐药的潜力。在临床前研究中,KL590586在体外和体内对RET激酶表现出良好的抑制活性,在动物模型中也表现出良好的血脑屏障穿透性。目前,科伦博泰正在中国开展KL590586针对晚期RET阳性非小细胞肺癌的关键临床研究。2021年3月,科伦博泰将KL590586包括美国和欧洲在内的部分地区独家授权给Ellipses Pharma,科伦博泰保留大中华区、韩国、新加坡和马来西亚等部分亚太地区的权利。2022年6月,KL590586获得FDA批准的新药临床研究申请(IND),进行RET基因改变的恶性肿瘤患者的1/2期临床研究。
2023年ASCO大会上报告了KL590586最新研究结果,KL590586在既往RET抑制剂耐药患者中显示出良好的抗肿瘤活性。在此报告了一项I/II期研究(KL400-I/II-01, NCT05265091)在RET改变的晚期肿瘤患者中的I期初步结果,以确定其安全性、药代动力学(PK)和疗效。截至2022年12月30日,研究纳入87例RET基因改变的晚期实体瘤患者,按研究设计分配到6个剂量组(10mg-120mg,QD)接受治疗。在该研究中,69例接受有效剂量(40mg-120mg)治疗的患者疗效可评估,其中57例为非小细胞肺癌(NSCLC),10例为甲状腺髓样癌(MTC),1例为胰腺癌,1例为卵巢癌。客观缓解率(ORR)为64%。截至数据截止日,绝大部分患者(58/69)仍在接受治疗,最长治疗时间超过11个月。在既往接受过系统治疗(中位线数为2,28%接受了抗PD-1/PD-L1治疗)的患者中,ORR为63%,疾病控制率(DCR)为91%,中位DOR未达到。其中9例接受第一代选择性RET抑制剂治疗后耐药的患者,7例肿瘤靶病灶缩小10%-69%,其中3例部分缓解(PR)、4例疾病稳定(SD)。在11例基线脑转移患者(既往未接受放疗)中,5例基线有可测量的脑部病灶,其中2例脑部病灶完全消失(100%),1例缩小80%,1例缩小47%。针对脑部病灶的DCR为100%。在既往未接受治疗的NSCLC患者中,ORR为76%,DCR为92%;4例为可测量脑部病灶患者(既往未接受放疗),3例脑部病灶响应为PR或CR。
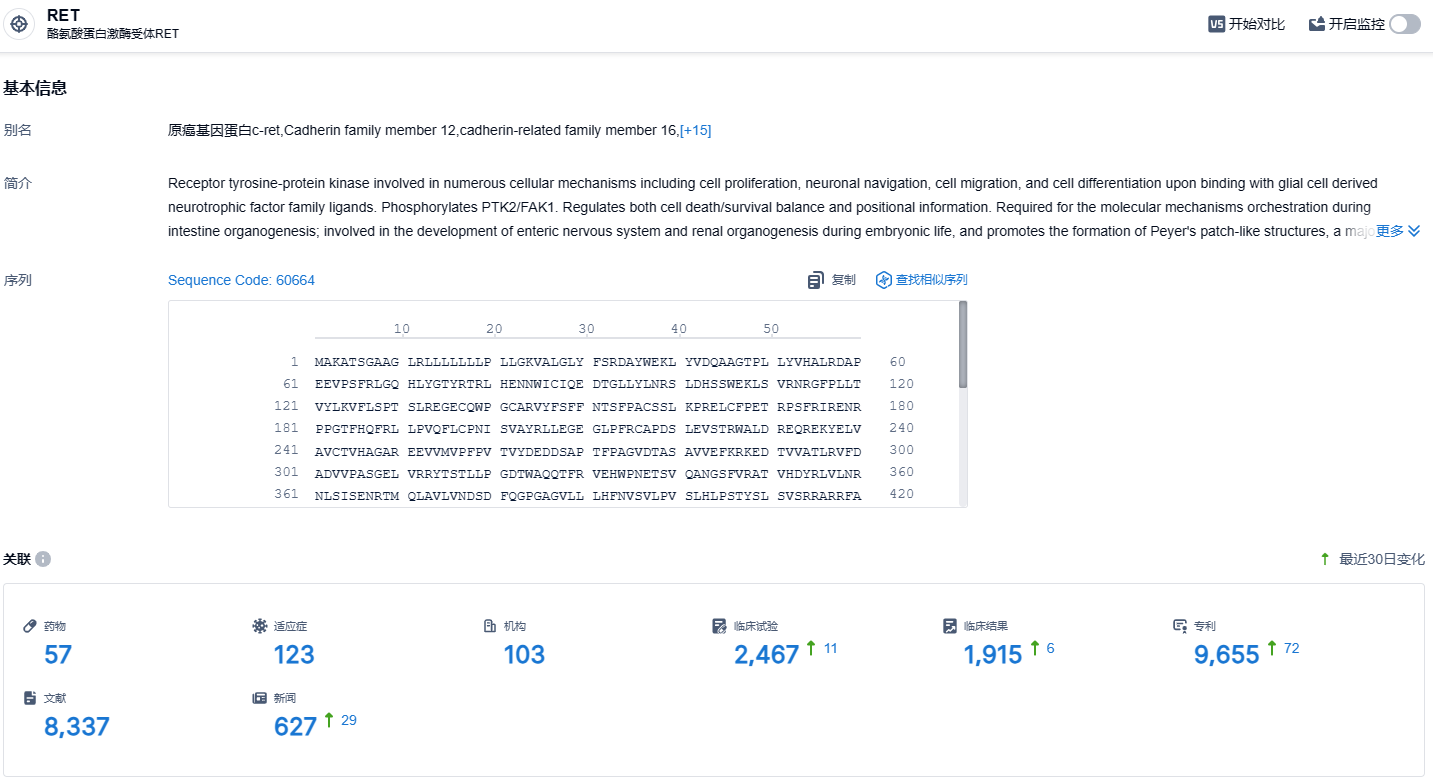
根据智慧芽新药情报库所披露的信息 (点击下方图片直达RET 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月28日,RET 靶点共有在研药物57个,包含的适应症有123种,在研机构103家,涉及相关的临床试验2467件,专利多达9655件……研究结果显示,KL590586在RET基因改变的肿瘤患者(包括第一代选择性RET抑制剂耐药和/或脑转移的NSCLC患者)中具有强大的临床活性,并且耐受性良好。期待KL590586的后续表现。