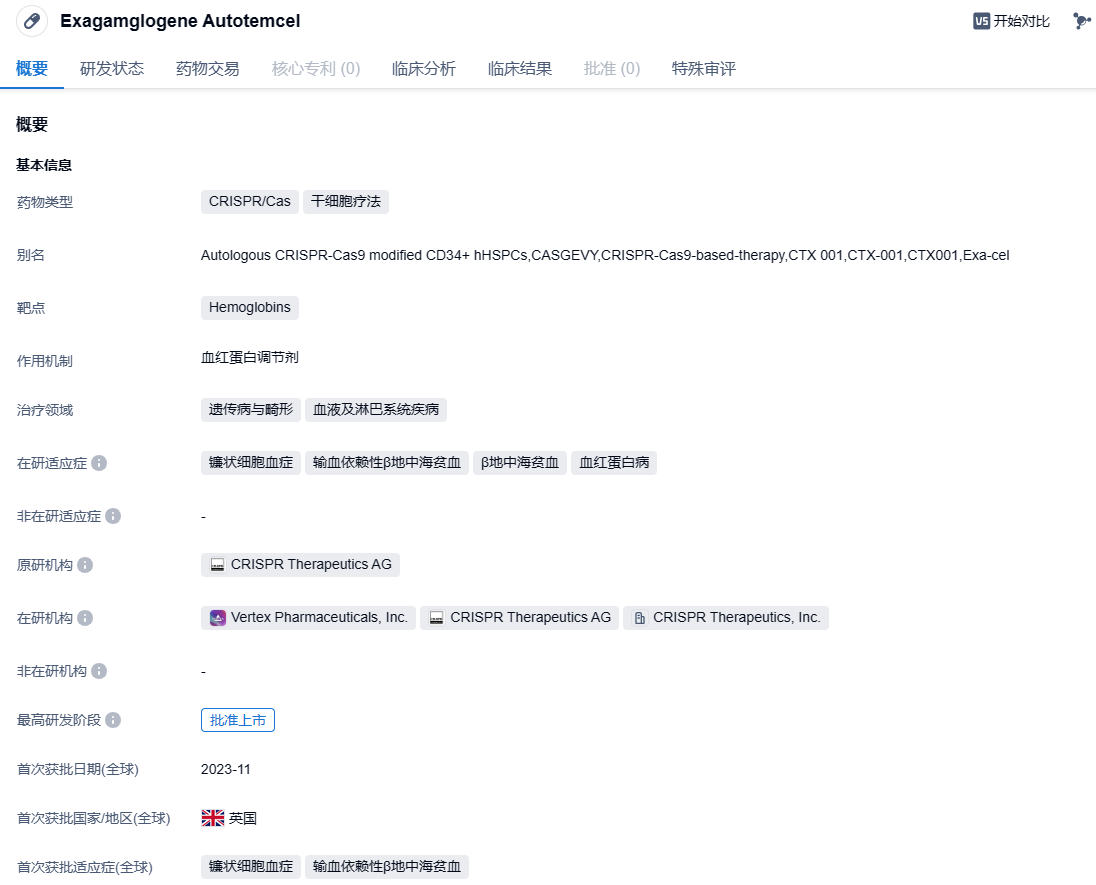
里程碑!全球首款CRISPR/Cas9基因编辑疗法Casgevy在英国获批
2023年11月17日,Vertex Pharmaceuticals和CRISPR Therapeutics共同宣布,英国药品和健康产品管理局(MHRA)已授予其CRISPR/Cas9基因编辑疗法Casgevy(exagamglogene autotemcel,exa-cel)有条件上市许可,用于治疗12岁及以上镰刀型细胞贫血病(SCD)伴复发性血管闭塞危象(VOCs)患者,以及无法获得人类白细胞抗原(HLA)匹配造血干细胞移植治疗的输血依赖性β地中海贫血(TDT)患者。这是全世界首款获批上市的CRISPR基因编辑疗法。
exa-cel是一款自体细胞疗法,它利用CRISPR/Cas9基因编辑系统,在体外对来自患者的造血干细胞进行编辑,使血红细胞生产高水平的胎儿血红蛋白(HbF)。exa-cel可以提高HbF水平,帮助缓解TDT患者的输血需求,并减少SCD患者的疼痛和血管闭塞性危象(VOC)。今年6月,Vertex Pharmaceuticals和CRISPR Therapeutics宣布,美国FDA已受理exagamglogene autotemcel(exa-cel)的生物制品许可申请(BLA),用于治疗严重镰状细胞病(SCD)和输血依赖性地中海贫血(TDT)。FDA授予SCD适应症优先审评资格,PDUFA日期为2023年12月8日,TDT适应症的PDUFA日期为2024年3月30日。
此前公布的临床试验结果显示,exa-cel具有一次治疗,提供功能性“治愈”的潜力。在接受治疗的44名输血依赖性β地中海贫血患者中,42名在随访时间为1.2~37.2个月时,不再需要接受输血,剩余两名患者接受的输血水平分别降低75%和89%。所有31名接受治疗的严重镰刀型细胞贫血病患者在随访时间为2.0~32.3个月时,均未出现血管闭塞性危象。
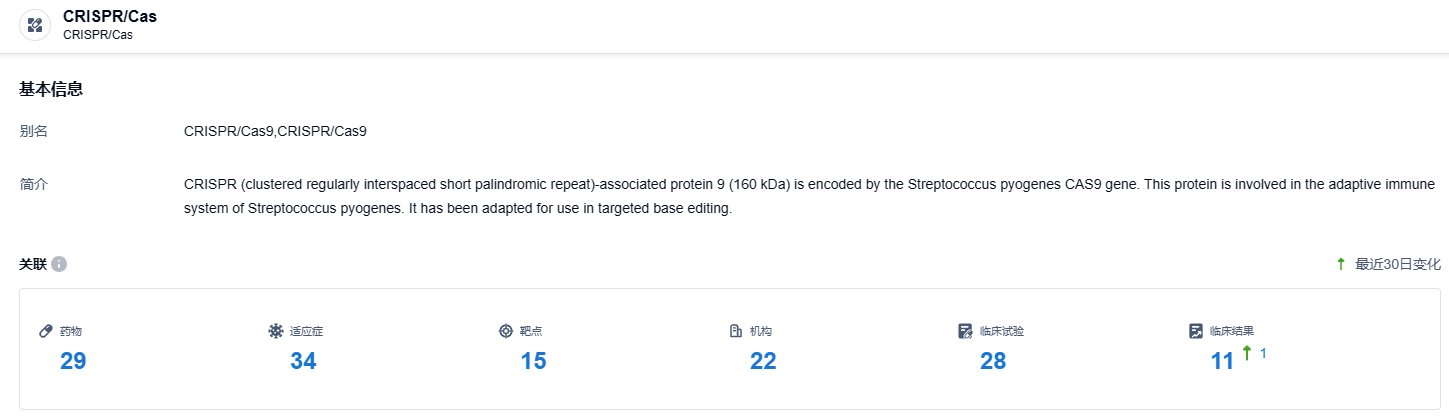
根据智慧芽新药情报库所披露的信息 (点击下方图片直达CRISPR/Cas药物类型注册登录后可免费获得该药物类型下的在研药物、适应症、靶点、研发机构、临床试验等详细信息),截止到 2023 年11月18日,CRISPR/Cas这一药物类型共有在研药物29个,包含的适应症有34种,靶点15个,在研机构22家,涉及相关的临床试验28件……CRISPR/Cas疗法是非常具有想象力的新药,在众多基因相关疾病中有着广泛的用途。由于该类疗法在各国监管机构中处于非常谨慎的审批态度,整体临床开发进度较慢,期待其未来的发展。