诺华司库奇尤单抗新适应症获FDA批准,治疗活动性中重度化脓性汗腺炎
2023年10月31日,诺华宣布FDA已批准司库奇尤单抗(secukinumab,商品名:Cosentyx)上市,用于治疗活动性中重度化脓性汗腺炎(HS)成人患者,这些患者对常规全身性HS疗法反应不足。
司库奇尤单抗全球首个全人源白介素类抑制剂,可特异性中和多种来源的IL-17A,抑制其促炎作用,治疗多种自身免疫性疾病,目前已获批银屑病关节炎、放射学阴性中轴型脊柱关节炎等多项适应症。2019年3月,司库奇尤单抗在中国获批上市,用于治疗适合系统治疗或光疗的中度至重度斑块状银屑病成人患者。
UNSHINE和SUNRISE是两项随机、双盲、安慰剂对照、多中心的III期临床,涉及40个国家的219个地区。其中,SUNSHINE纳入分析的有541名受试者,SUNRISE纳入分析的有543名受试者。具体治疗方案如下:受试者按1:1:1随机分组,接受司库奇尤单抗300mg每2周(Q2W组)或每4周(Q4W组)或安慰剂(安慰剂组)治疗,并每天外用抗生素作为辅助治疗。16周治疗期结束后,各组患者可继续治疗至第52周以评估长期疗效,Q2W组和Q4W组保持原用药方案,而安慰剂组则换用司库奇尤单抗300mg Q2W或Q4W治疗。主要终点为第16周的HS应答率,应答定义为脓肿和炎症性结节数量减少≥50%,或者脓肿或窦道数量与基线相比无增加。结果显示,两项研究的Q2W组均达到主要疗效终点。其中,SUNSHINE研究Q2W组的HS应答率为45%,显著高于安慰剂组的34%;SUNRISE研究Q2W组的HS应答率为42%,同样显著高于安慰剂组的31%。Q4W组,SUNSHINE研究的HS应答率为42%,与安慰剂组无显著差异(34%);SUNRISE研究的HS应答率为46%,显著高于安慰剂组(31%)。第52周时,SUNSHINE研究Q2W组的HS应答率升至76%,Q4W组升至81%;SUNRISE研究Q2W组的HS应答率升至84%,Q4W组升至77%。安全性方面,两项试验最常见的AEs是头痛。总之,司库奇尤单抗安全性良好,与之前报道的一致,未发现新的安全性信号。
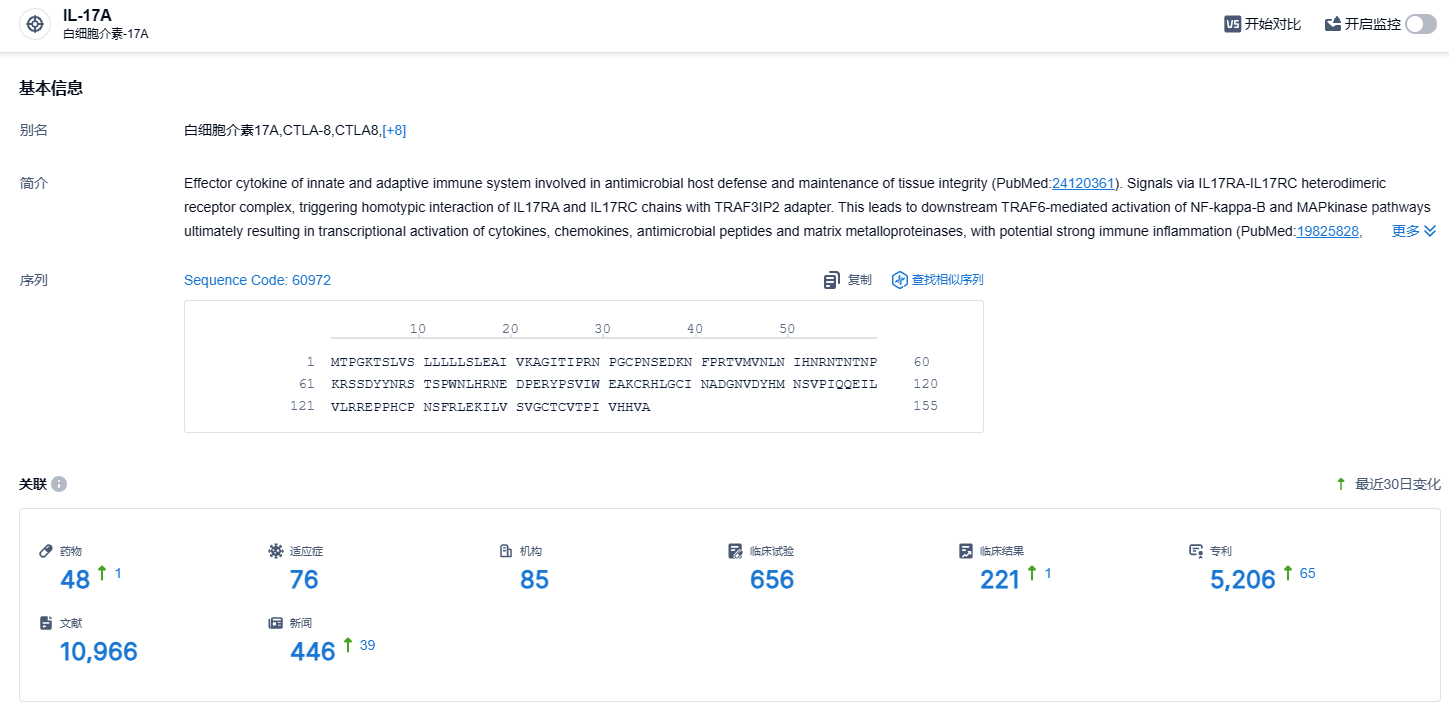
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达IL-17A靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月2日,IL-17A 靶点共有在研药物48个,包含的适应症有76种,在研机构85家,涉及相关的临床试验656件,专利多达5206件……IL-17A靶点在治疗自身免疫性疾病有着非常多有效证据,国内有不少药企布局该靶点,期待该领域能够出现成功上市的国产新药。