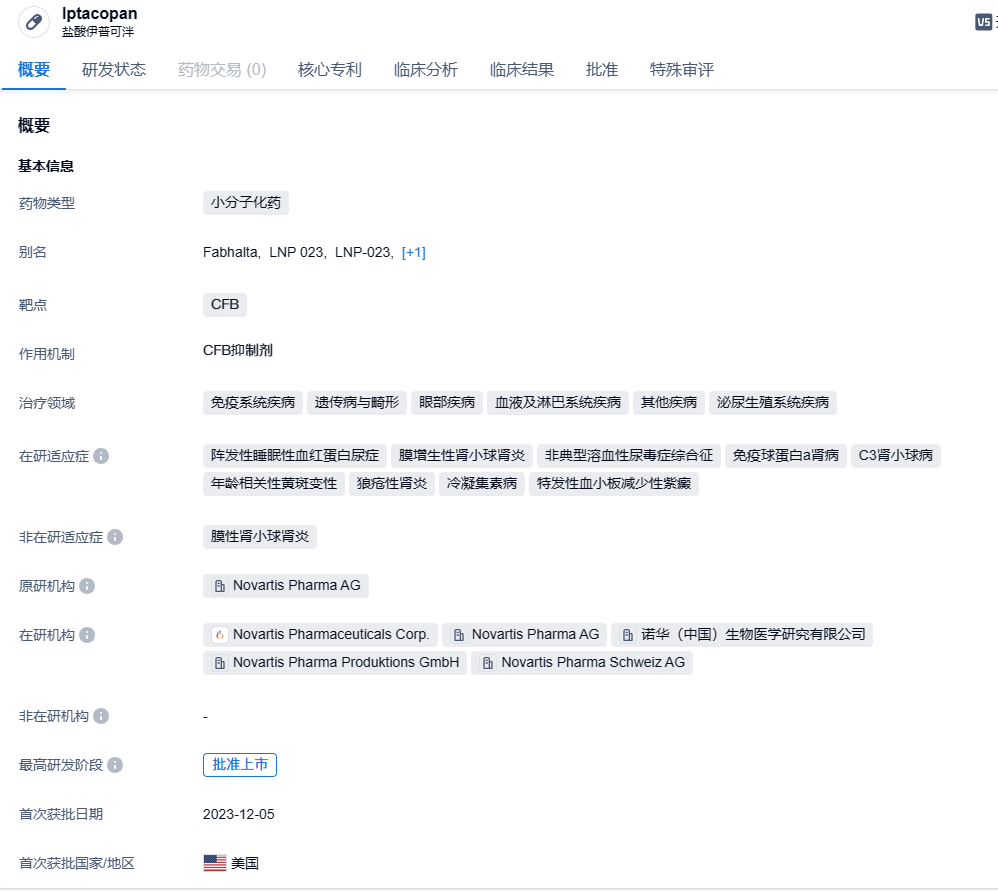
诺华重磅口服补体抑制剂iptacopan III期临床试验成功,治疗C3肾小球病
2023年12月11日,诺华宣布,其口服补体B因子抑制剂iptacopan(伊普可泮)治疗C3肾小球病的III期APPEAR-C3G研究达到主要终点。
伊普可泮(iptacopan)是诺华在研的一款潜在“first-in-class”口服补体途径因子B(CFB)抑制剂,此前曾被CDE纳入突破性治疗品种,拟用于治疗PNH。伊普可泮作用于补体系统C5末端通路的上游,同时控制血管内溶血和血管外溶血,弥补了抗C5抗体的不足,同时为患者提供了口服单药的治疗选择。2023年6月5日,盐酸伊普可泮胶囊在国内拟纳入优先审评,拟纳入的理由是符合临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药。2023年6月14日,CDE官网显示,诺华盐酸伊普可泮胶囊(iptacopan)上市申请获受理,用于成人阵发性睡眠性血红蛋白尿症(PNH)患者的治疗。2023年12月6日,诺华公司(Novartis)宣布,美国FDA批准Fabhalta(iptacopan,伊普可泮)上市,作为治疗成人阵发性夜间血红蛋白尿症(PNH)的首个口服单药疗法。Fabhalta是一种补体B因子抑制剂,它在免疫系统的替代补体途径中起作用,全面控制血管内外的红细胞(RBC)破坏。
诺华制药报告了六个月双盲期的针对C3肾小球病患者治疗的iptacopan III期APPEAR-C3G的积极顶线结果。在6个月的背景治疗基础上,iptacopan(200mg,每天两次)相较于安慰剂在减少蛋白尿方面具有优势,且这种减少具有临床意义和统计学意义。Iptacopan的安全性与之前报告的数据一致。APPEAR-C3G研究将继续进行为期6个月的开放标签期,所有患者都将接受iptacopan治疗,包括之前接受安慰剂治疗的患者。此外,另一项针对C3G青少年患者的队列研究也在进行中。诺华制药计划与全球卫生当局审查结果,以便于2024年可能提交申请。
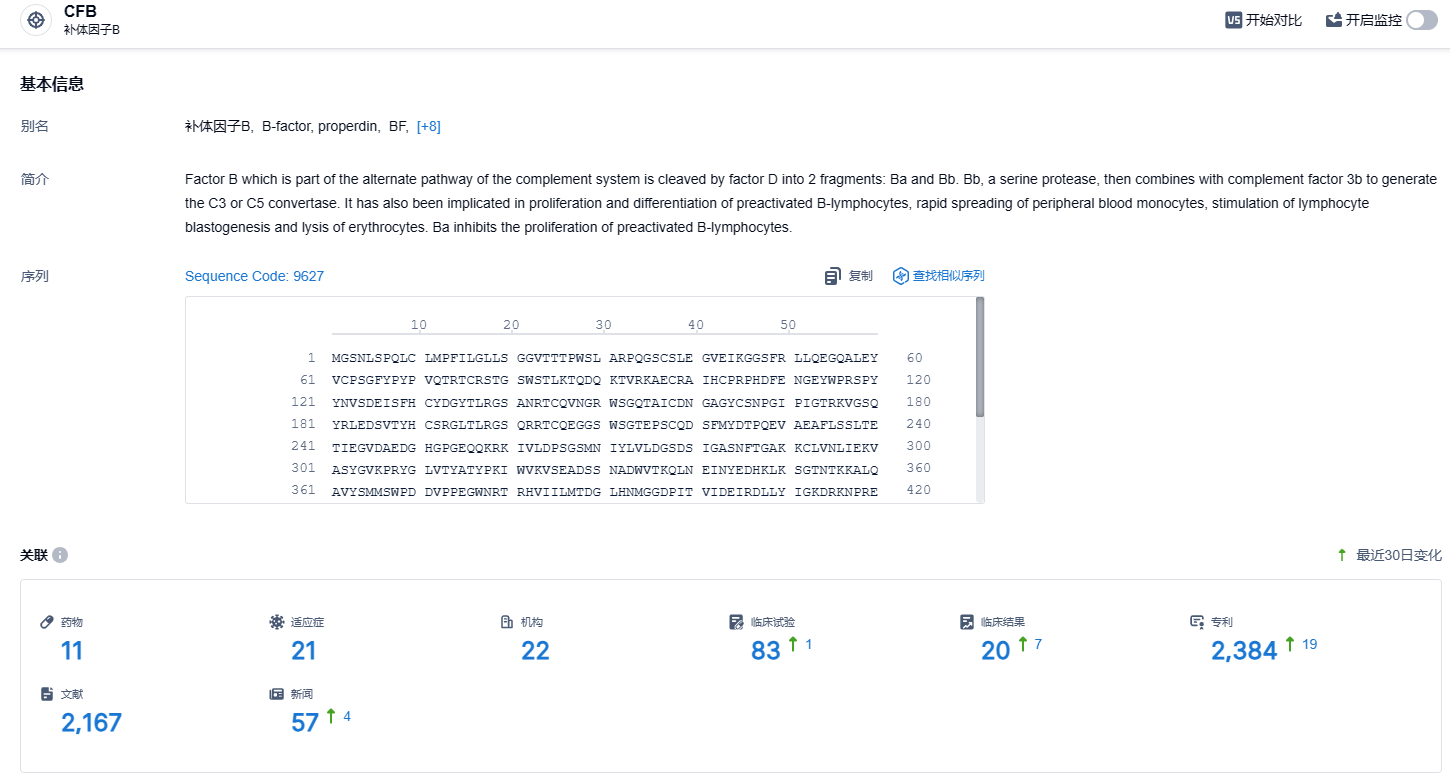
根据智慧芽新药情报库所披露的信息(点击下方卡片直达CFB靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2023年12月12日,CFB靶点共有在研药物11个,包含的适应症有21种,在研机构22家,涉及相关的临床试验83件,专利多达2384件……伊普可泮试验数据优秀,有望成为CFB靶点领域best in class的存在,期待该药早日在国内上市,给患者带来新的治疗选择。