再生元计划向FDA递交BCMA/CD3双抗linvoseltamab上市申请,治疗多发性骨髓瘤
2023年12月7日,再生元宣布关键I/II期LINKER-MM1试验的中期分析结果显示,接受BCMA/CD3双抗linvoseltamab治疗的复发/难治性(R/R)多发性骨髓瘤(MM)患者出现深度且持久缓解。在11个月的中位随访期间,独立审查委员会评估的客观缓解率(ORR)为71%,46%的患者实现完全缓解或更好疗效。再生元计划今年基于I/II期研究结果向美国FDA等监管当局递交生物制品许可(BLA)申请。
Linvoseltamab是一款在研BCMA + CD3双特异性抗体,结合了再生元独有的全人源抗体技术VelocImmune和全长双抗技术平台VelociBi,与人体天然的抗体非常接近。Linvoseltamab旨在通过连接多发性骨髓瘤细胞上的BCMA和表达CD3的T细胞,促进T细胞活化和癌细胞杀伤。该药物已获得美国FDA的快速通道资格,用于治疗多发性骨髓瘤。
该试验的I期静注剂量递增部分现已完成,主要评估了linvoseltamab在9个剂量水平上的安全性、耐受性和剂量限制性毒性,探索了不同的给药方案。该试验的II期剂量扩展部分(LINKER-MM1)正在进一步评估linvoseltamab的安全性和抗肿瘤活性,主要终点是ORR。关键的次要终点包括缓解持续时间、PFS、最小残留疾病阴性状态率和总生存期。在11个月的中位随访期间,117例接受linvoseltamab 200mg治疗的患者中,经独立审查委员会评估的ORR为71%,46%的患者达到完全缓解或更好疗效。经过至少24周的治疗,获得非常好的部分缓解(VGPR)或更好疗效的患者从每2周给药改为每4周给药。
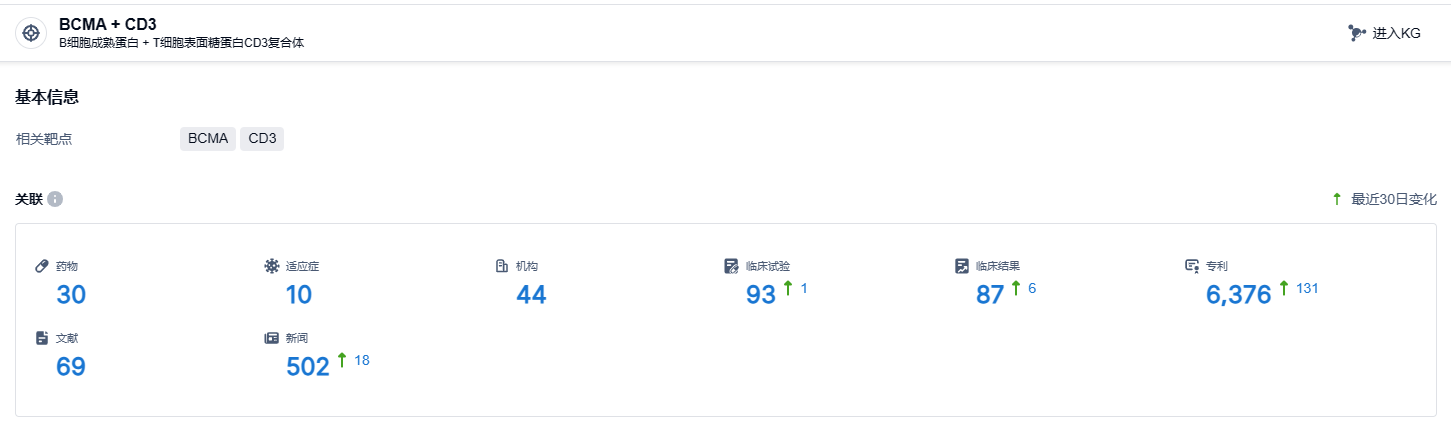
根据智慧芽新药情报库所披露的信息 (点击下方图片直达BCMA + CD3 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年12月9日,BCMA + CD3靶点共有在研药物30个,包含的适应症有10种,在研机构44家,涉及相关的临床试验93件,专利多达6376件……目前已经有多款BCMA/CD3靶点新药正在积极研发中,强生的Teclistamab和辉瑞的Elranatamab已获批上市;康诺亚生物的CM336、岸迈生物的EMB-06、TeneoBio/艾伯维的TNB-383B均已进入I/II期等。期待再生元的linvoseltamab能够早日上市。