奥马珠单抗新适应症sBLA获FDA优先审评,治疗多种食物过敏
2023年12月20日,罗氏(Roche)宣布,美国FDA已接受Xolair(omalizumab)的补充生物制品许可申请(sBLA),用于减少成人和1岁以上儿童因意外暴露于一种或多种食物而可能发生的过敏反应,包括过敏性休克。FDA同时授予这一申请优先审评资格。新闻稿指出,如果获批,Xolair将成为首个在对多种食物过敏的患者中,减少因意外暴露所产生过敏反应的药物。预计FDA将在2024年第一季度做出批准决定。
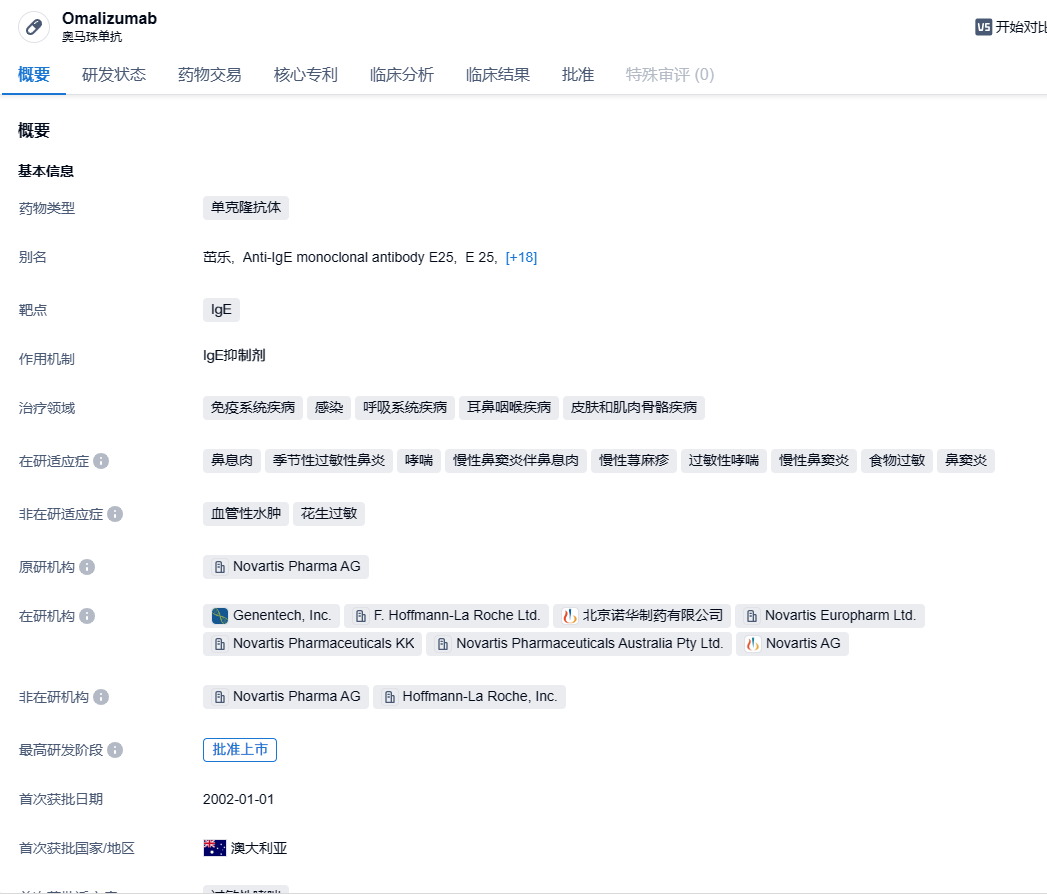
奥马珠单抗是诺华开发的一款靶向荨麻疹核心—IgE的生物制剂,它可以通过精准结合并阻断IgE,从而阻断包括组胺在内的一系列炎症因子的释放,阻止变态反应的发生,从而达到治疗荨麻疹、哮喘等适应症的目的。目前,该药物已获批用于治疗慢性特发性荨麻疹、慢性鼻-鼻窦炎伴鼻息肉、哮喘等适应症。在美国,罗氏旗下的基因泰克和诺华共同负责开发和推广Xolair。在中国,奥马珠单抗在2017年获得NMPA批准,用于治疗成人及6岁以上儿童的中重度过敏性哮喘。在2022年4月,奥马珠单抗获批用于治疗采用H1抗组胺药治疗后仍有症状的成人和青少年(12岁及以上)慢性自发性荨麻疹患者。
这一申请得到了由美国国家过敏和传染病研究所(NIAID)主导的3期临床试验OUtMATCH的支持。在预定的中期分析中,独立数据安全监测委员会(DSMB)审查了参与试验第一阶段的前165名年龄在1至17岁的儿童和青少年患者的数据,并确定研究达到了其主要终点和关键次要终点。这些中期结果显示,与安慰剂相比,Xolair显著增加了引起儿童和青少年发生过敏反应所需的花生(主要终点)以及牛奶、鸡蛋和腰果(关键次要终点)的数量。
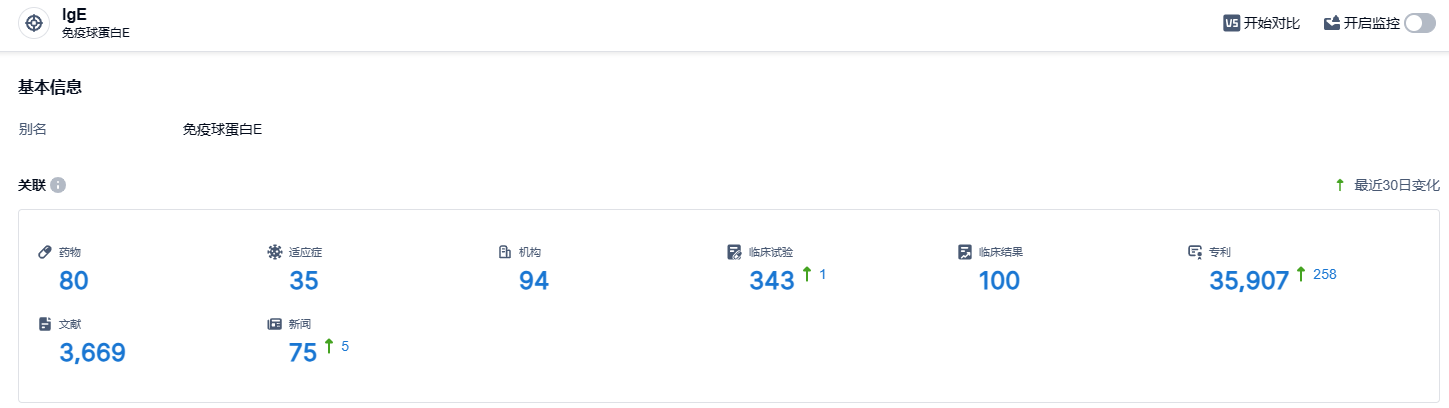
根据智慧芽新药情报库所披露的信息 (点击下方图片直达IgE靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年12月21日,IgE靶点共有在研药物80个,包含的适应症有35种,在研机构94家,涉及相关的临床试验343件,专利多达35907件……在美国,食物过敏影响多达1700万儿童和成人。据估计,在美国,每年在急诊室就诊的与食物有关的过敏反应医疗事件多达30000例。奥马珠单抗有望为过敏患者带来新的治疗选择。