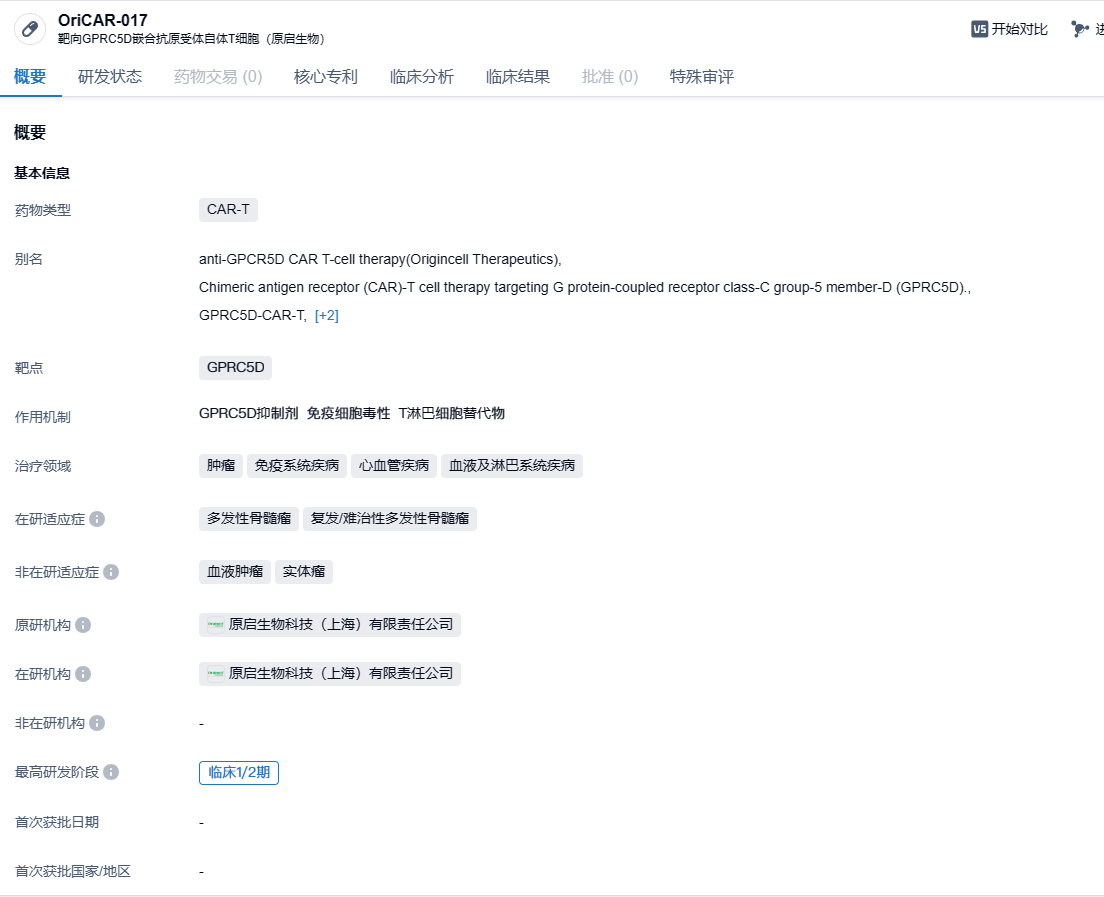
原启生物靶向GPRC5D CAR-T疗法OriCAR-017获FDA快速通道资格,总缓解率100%!
7月15日,原启生物宣布,美国FDA已授予公司靶向GPRC5D的CAR-T细胞注射液 (OriCAR-017) 快速通道资格,用于治疗复发/难治性多发性骨髓瘤 (RRMM) 。原启生物新闻稿指出,获得这一资格将有利于OriCAR-017加快推进临床试验以及上市注册进度。此前,FDA已授予OriCAR-017孤儿药资格,并批准了该新药临床试验申请 (IND)。
OriCAR-017是原启生物开发的一款靶向GPRC5D的CAR-T细胞疗法,用于治疗复发/难治多发性骨髓瘤。GPRC5D是G蛋白偶联受体家族C组5成员D,在多发性骨髓瘤(MM)细胞中特异性高表达,几乎不在正常组织上表达。GPRC5D在CD138+细胞上与BCMA呈独立表达,因此无论是对于复发难治的末线患者,还是对于曾接受BCMA为靶点的CAR-T、双抗或ADC药物治疗后BCMA低表达或阴性的复发病例,GPRC5D靶向药物都有望成为新的治疗选择。2023年8月10日,原启生物靶向GPRC5D治疗复发难治性多发性骨髓瘤(R/R MM)的CAR-T产品OriCAR-017注射液的新药临床试验(IND)申请,获得中国国家药品监督管理局(NMPA)正式批准。2024年1月29日,原启生物(Oricell Therapeutics)宣布美国FDA正式批准其OriCAR-017用于治疗复发/难治性多发性骨髓瘤(R/R MM)患者的新药临床申请(IND)。
OriCAR-017的探索性临床研究最新数据显示,中位随访时间为280天(217 ~ 459天),总体缓解率(ORR)达到100%,严格意义的完全缓解(sCR)达到80%。此外,OriCAR-017表现出明显的安全优势,经治疗后患者仅出现1例2级细胞因子释放综合征(CRS),其余均为1级,未发现免疫效应细胞相关神经毒性综合征(ICANS),且没有出现3级及以上的皮肤毒性和指甲变化。尤其值得一提的是,在接受治疗后的长期随访中未观察到感染事件发生。
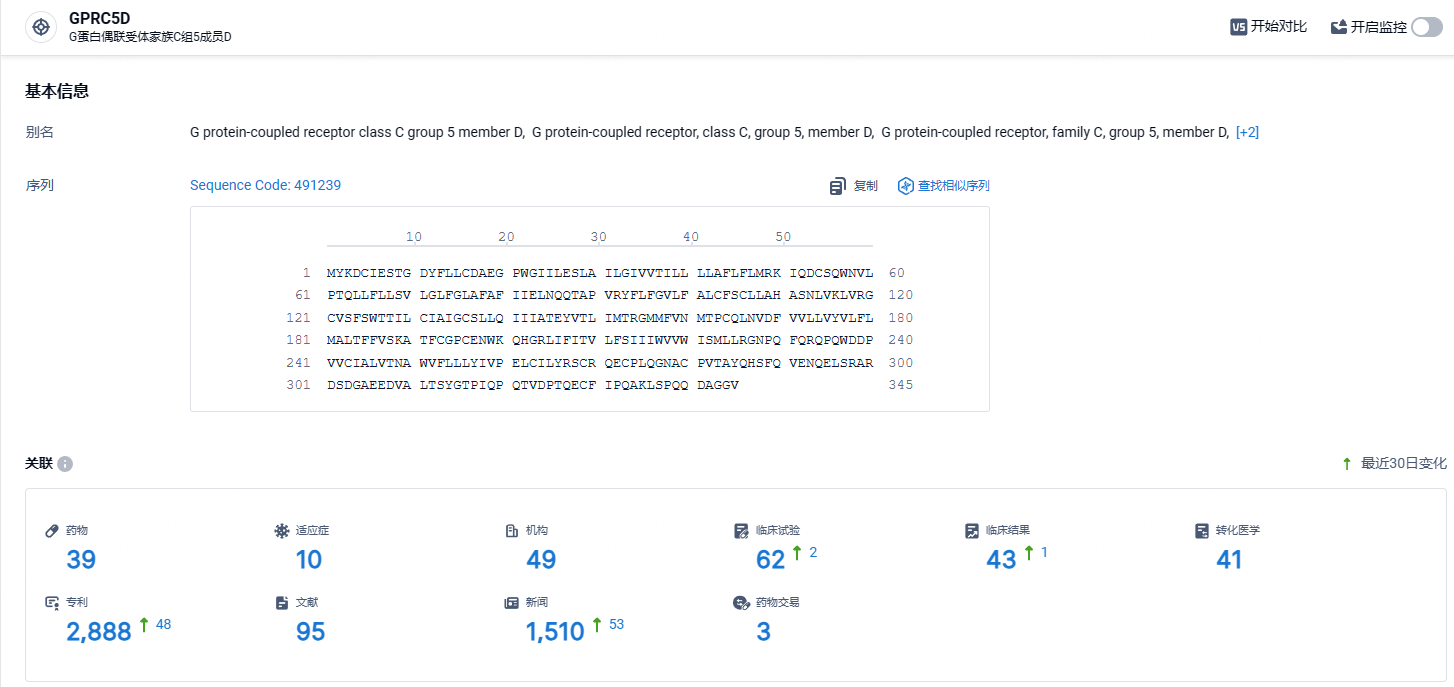
根据智慧芽新药情报库所披露的信息 (点击下方图片直达GPRC5D靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年1月30日,GPRC5D靶点共有在研药物29个,包含的适应症有13种,在研机构40家,涉及相关的临床试验42件,专利多达2154件……OriCAR-017在治疗已接受多种治疗方案的复发或难治性多发性骨髓瘤患者方面具有可控的安全性和有希望的活性。在BCMA靶向CART细胞治疗后复发的患者可能受益于OriCAR-017。然而,由于当前临床研究中的患者数量较少,需要进一步的临床数据来证明OriCAR-017的安全性和有效性。