赛诺菲BTK抑制剂Rilzabrutinib III期临床达到主要终点,针对免疫性血小板减少症
2024年4月23日,赛诺菲宣布其研发的BTK抑制剂Rilzabrutinib(SAR444671/PRN-1008)在治疗持续性或慢性免疫性血小板减少症(ITP)成年患者的III期LUNA 3研究中达到了主要终点。赛诺菲计划于今年年底前向FDA提交Rilzabrutinib的上市申请。
Rilzabrutinib是一种口服、可逆、共价BTK抑制剂,它有望成为多种免疫介导疾病的“first-in-class”或“best-in-class”治疗药物。作为BTK的高亲和力抑制剂,它有可能靶向参与炎症和自身免疫的多种通路和细胞类型,这些包括:B细胞受体介导的B细胞通路、FcyR诱导的单核细胞和巨噬细胞释放细胞因子、FccR诱导的肥大细胞脱颗粒和粒细胞迁移及介质释放。与ITP治疗相关,rilzabrutinib治疗在体外可显著抑制人B细胞活化,并通过Fc受体信号传导阻断抗体(IgG、IgE)介导的免疫细胞活化。通过应用赛诺菲的TAILORED COVALENCY技术,rilzabrutinib可以选择性地抑制BTK靶点,同时有可能降低产生脱靶副作用的风险。
LUNA 3 研究旨在评估 Rilzabrutinib 对比安慰剂治疗既往接受过治疗的持续性或慢性 ITP 成年和青少年患者的疗效和安全性。双盲治疗期持续 12-24 周,患者接受 Rilzabrutinib(400 mg;每天两次)或安慰剂治疗,随后进行 28 周的开放标签治疗,再是进行 4 周的安全随访期或长期扩展研究。研究主要终点为产生持久血小板应答(即在没有挽救治疗的情况下,患者在 24 周双盲治疗期的最后 12 周中至少有 8 周血小板计数 ≥ 50000/μL)的比例。患者的基线血小板计数为 15000/μL(正常水平为 150000-450000/μL)。当前已完成成年亚组部分,结果显示达到主要终点,Rilzabrutinib 组产生持久血小板应答的患者比例显著高于安慰剂组,数据具有临床意义和统计学意义。在安全性方面,Rilzabrutinib 的安全性与既往研究一致。详细结果将于此后的医学大会上公布。该试验的青少年亚组仍在进行中,正在招募受试者。
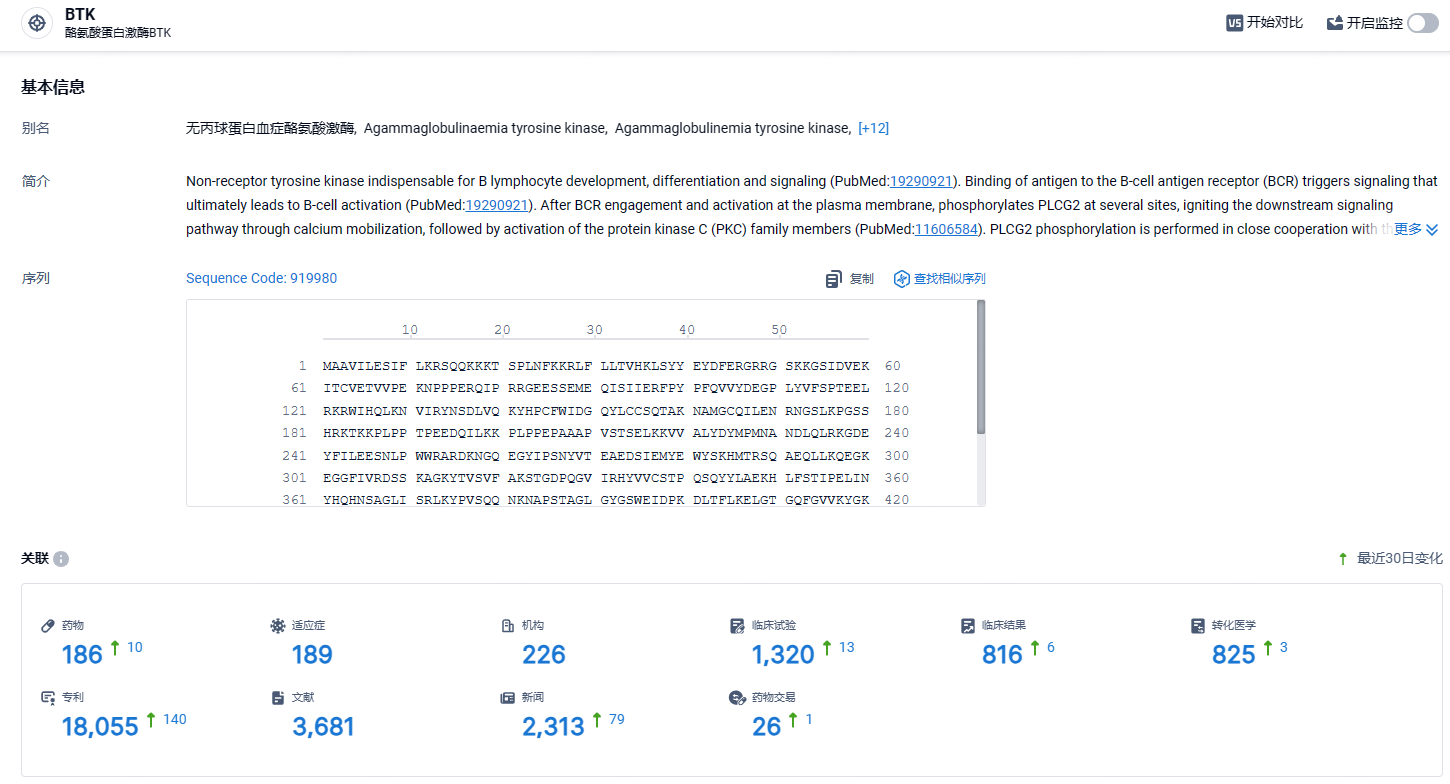
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达BTK靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年4月25日,BTK靶点共有在研药物186个,包含的适应症有189种,在研机构226家,涉及相关的临床试验1320件,专利多达18055件……BTK靶点已被证明在治疗B细胞瘤方面卓有成效,但在用于自身免疫性疾病治疗方面,百时美施贵宝、吉利德和罗氏等公司均遭受挫折。期待赛诺菲这款BTK抑制剂能够研发顺利。