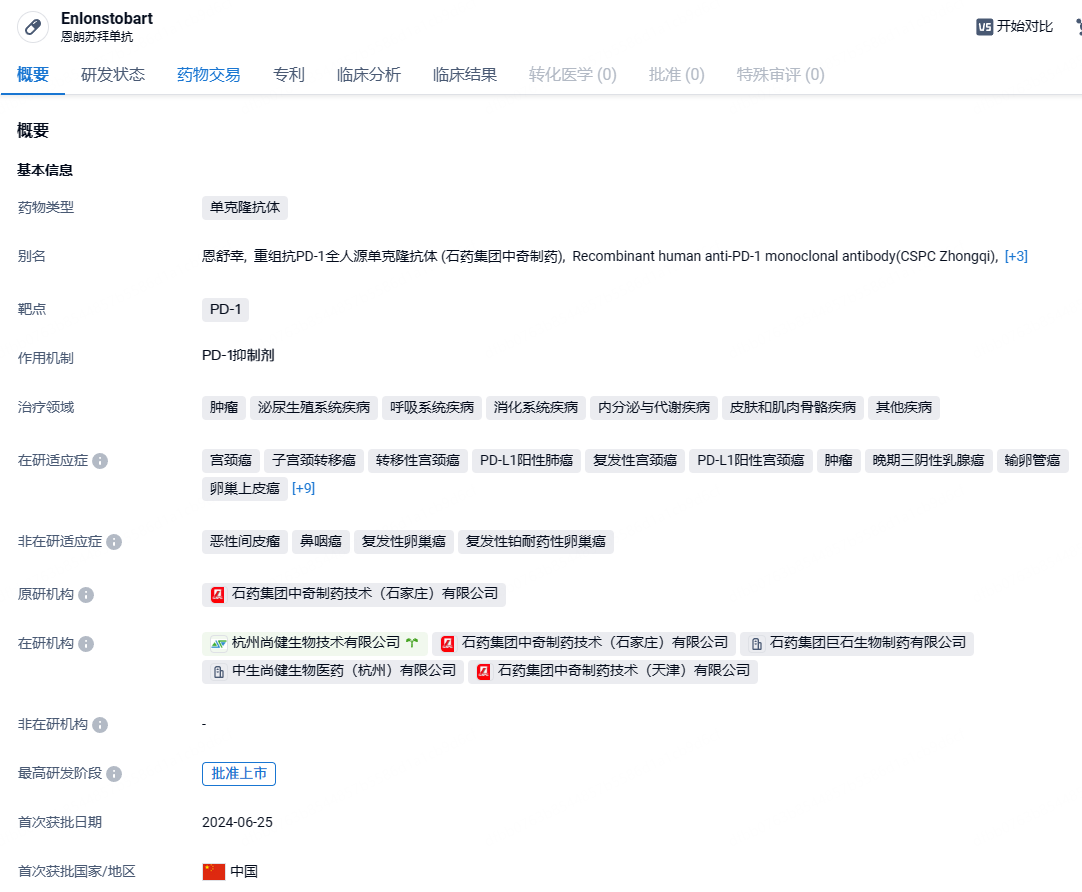
石药集团PD-1抗体恩朗苏拜单抗注射液获批上市,针对宫颈癌
2024年6月28日,石药集团子公司巨石生物制药研发的恩朗苏拜单抗注射液(商品名:恩舒幸)的上市申请已获药监局批准。本次申报的适应症为治疗至少一线含铂方案化疗失败的PD-L1表达阳性的复发或转移性宫颈癌患者。截止目前,国内PD-(L)1单抗数量来到了20款。
恩朗苏拜单抗注射液是重组抗PD-1全人源单克隆抗体,属IgG4型单抗药物,通过靶向人类程序性细胞死亡蛋白-1(PD-1),逆转PD-1通路介导的抑制免疫反应,从而激活机体抗肿瘤免疫反应。该产品本次获批的适应症是用于治疗既往接受含铂化疗治疗失败的PD-L1表达阳性(CPS≥1)的复发或转移性宫颈癌患者。恩朗苏拜单抗注射液最早是由尚健生物研发,2018年9月29日首次获批临床,同年11月,才被石药集团引入并达成战略合作。
在 ASCO 2024 大会上公布的 II 期研究(NCT04886700)进一步验证了其安全性和有效性。该 II 期研究共纳入 107 名 PD-L1 阳性(CPS≥1)的宫颈癌患者,她们在接受一线铂类治疗期间或之后出现了疾病进展或对一线铂类治疗不耐受。患者每两周接受一次 240 mg 的恩朗苏拜单抗治疗,治疗周期最长为 24 个月,直至出现疾病进展、不可耐受的毒性或其他研究终止标准。结果显示,在中位随访 13.96 个月后,患者的 ORR 和 DCR 分别为 29.0%(95% CI,20.6-38.5)和 54.2%(95% CI,44.3-63.9),其中包括两例完全缓解和 29 例部分缓解。mDoR 为 16.6 个月(95% CI,10.8-NA),mPFS 为 3.1 个月(95% CI,2.2-6.9)。
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PD-1 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年6月29日,PD-1 靶点共有在研药物437个,包含的适应症有732种,在研机构625家,涉及相关的临床试验7958件,专利多达79752件……PD-1/PD-L1靶点是研发非常火热的领域,国内目前已经有20款相关新药上市,诸如恒瑞的卡瑞利珠单抗年销售额峰值更是接近50亿元人民币。在这一红海市场,商业化与更进一步的临床推进成了药企pk的重中之重,K药和O药是该赛道的标杆,国产PD-1/PD-L1新药如何与K药、O药竞争是不得不面对的难题。