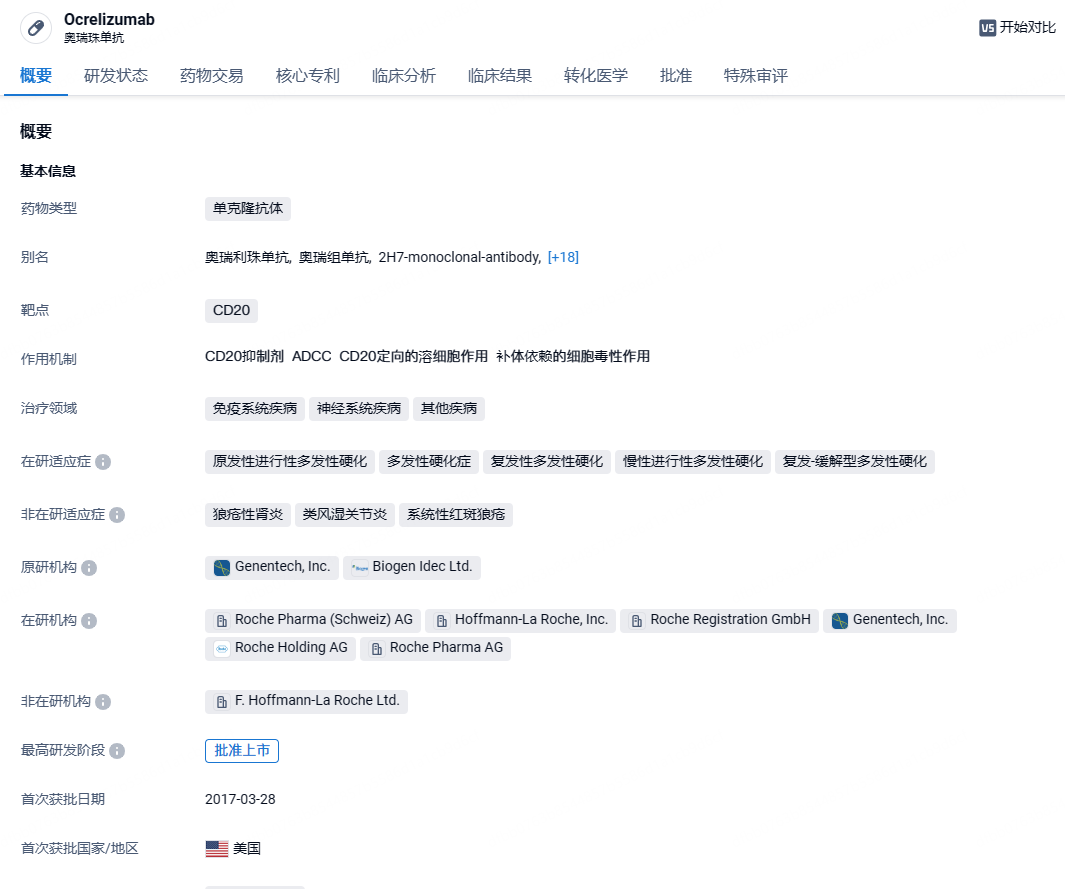
罗氏宣布CD20靶向抗体Ocrevus皮下注射制剂获欧盟批准,针对多发性硬化
2024年6月26日,罗氏(Roche)宣布,欧盟委员会已批准其CD20靶向抗体Ocrevus(ocrelizumab)皮下注射制剂用于治疗复发性多发性硬化(RMS)和原发性进展型多发性硬化(PPMS)。之前公布的临床结果显示,只需一年两针、每次仅需10分钟注射时间的Ocrevus皮下注射制剂几乎完全抑制了临床复发和脑部病变。
ocrelizumab 是一种人源化的抗CD20 单克隆抗体,选择性地靶向CD20阳性B细胞,这是一种特定类型的免疫细胞,被认为是导致髓鞘和轴突损伤的关键因素,这种神经损伤可在多发性硬化症(MS)患者中导致残疾。2017年3月28日,ocrelizumab被FDA批准用于治疗多发性硬化症(MS)。2023年,Ocrevus(ocrelizumab)销售额高达74亿美元,已经成为了罗氏旗下最赚钱的产品之一。今年4月,罗氏宣布,其重磅抗体疗法Ocrevus(ocrelizumab)在治疗复发性或原发进展性多发性硬化(RMS或PPMS)的3期临床研究OCARINA II中获得积极数据。结果显示,只需一年两针的Ocrevus皮下注射制剂几乎完全抑制了临床复发和脑部病变。Ocrevus皮下制剂的监管申请目前正在接受美国监管机构的审评,有望今年获得批准。
今年4月更新的长期随访结果显示,Ocrevus皮下注射(920毫克;n=236)在治疗阶段内几乎完全抑制了复发活动(97.2%的患者在治疗期间未发生复发)。在48周的核磁共振成像(MRI)检测中的年复发率为0.04,绝大多数患者无Gd+T1病变和无新的/扩大的T2病变。这些病变类型分别是活动性炎症和疾病负担的标志。此外,在探索性的患者报告结果指标中,患者(n=52)报告了高水平的满意度(92.3%的患者感到满意或非常满意)和便捷性(90.1%的患者认为它方便或非常方便)。额外数据继续显示Ocrevus皮下注射的安全性与已建立的Ocrevus静脉输注的安全性相符。未发现新的安全信号。Ocrevus皮下注射组中最常见的不良事件是注射反应(所有接受治疗的患者中有51.5%),包括红斑(34.8%)、疼痛(17.2%)、肿胀(9.4%)和瘙痒(5.6%),所有这些不良事件都是轻度或中度的,没有导致治疗中断。
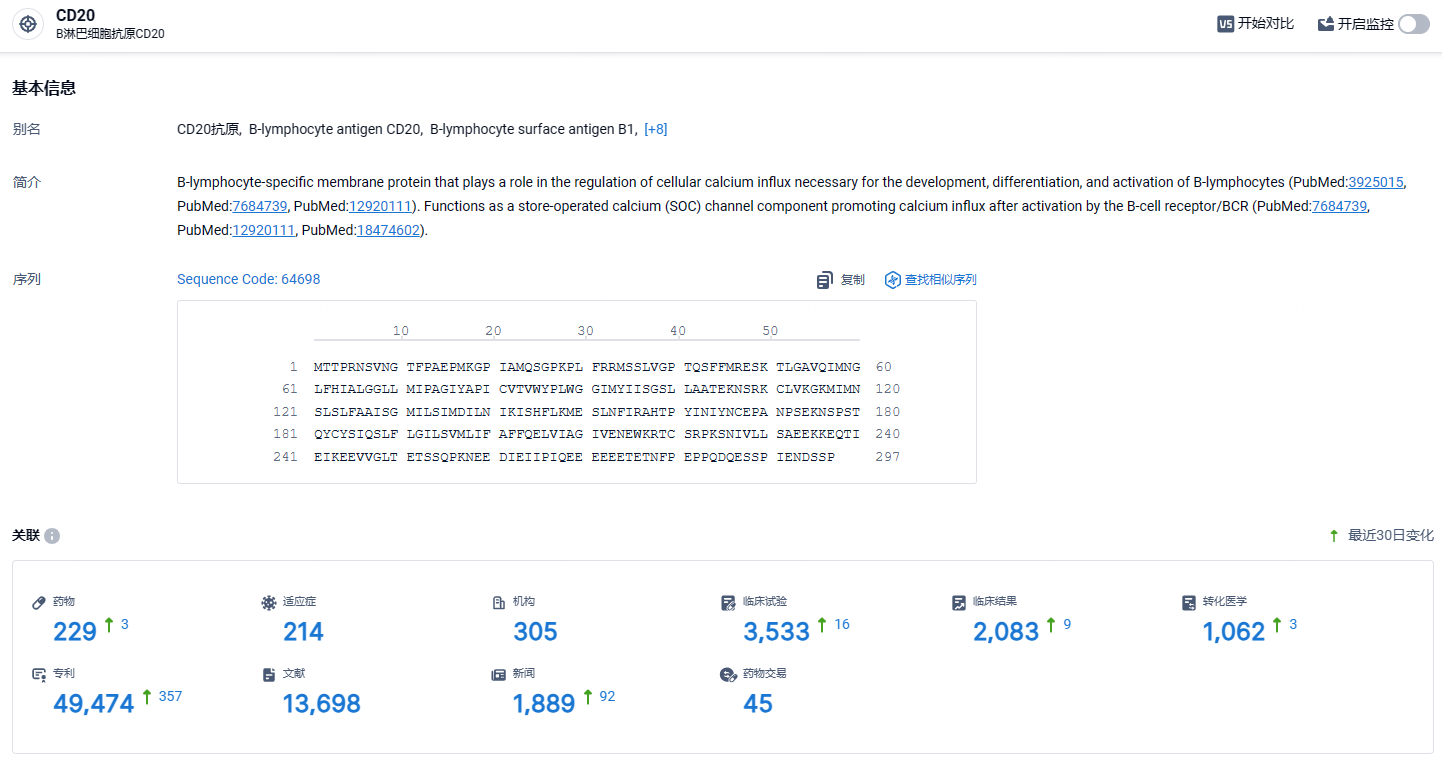
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达CD20靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年6月27日,CD20靶点共有在研药物229个,包含的适应症有214种,在研机构305家,涉及相关的临床试验3533件,专利多达49474件……ocrelizumab在多发性硬化症领域已经占据了销售额榜首位置,期待该药能够进入国内,给国内患者带来新的治疗选择。




